Simposio
Terapia fetal intracardiaca: comunicación de la primera intervención cardiaca fetal exitosa en el Perú, con correlación posnatal al nacimiento y a los 18 meses de vida
1Clínica Delgado Auna, Lima, Perú
2Instituto Peruano de Medicina y Cirugía Fetal, Lima, Perú.
La anemia fetal es una causa de morbilidad y mortalidad perinatal. Aunque tiene diferentes etiologías y a pesar de la introducción de la profilaxis de inmunoglobulina RhD, la aloinmunización sigue siendo una de sus principales causas. Estos embarazos se identifican inicialmente midiendo en el feto la velocidad sistólica máxima de la arteria cerebral media (MCA-PSV) y se debe sospechar de anemia moderada a grave cuando el MCA-PSV es ≥1,50 múltiplos de la mediana. En estos casos, el hematocrito real se determina obteniendo sangre fetal. La intervención con una hemoglobina fetal no menor a 7 g/dL resulta en un mejor resultado fetal en comparación a esperar hasta el desarrollo de anemia grave < a 5 g/dL o hidrops. La transfusión fetal intravascular es preferible a la transfusión intraperitoneal debido a mayores tasas de supervivencia, particularmente de fetos hidrópicos. La vena umbilical es el sitio vascular preferido debido a la facilidad de acceso y una mayor seguridad en comparación con otros sitios vasculares. La punción cardíaca directa rara vez se realiza debido a un mayor riesgo de complicaciones graves, incluida la muerte fetal. En el presente artículo presentamos el primer caso comunicado en nuestro medio de transfusión intracardiaca en un feto con anemia severa por isoinmunización Rh, el cual tuvo un manejo exhaustivo y difícil, pero con una excelente evolución fetal, neonatal y posnatal.
Palabras clave: Anemia fetal; Isoinmunización Rh; Corazón fetal; intervención; Transfusión sanguínea; intracardiaca
Introducción
Los casos de enfermedad hemolítica del feto y recién nacido se describen desde los años de Hipócrates. En 1932, Diamond caracterizó la enfermedad neonatal como eritroblastosis fetal1 y Levine, en 1941, demostró la relación causal entre anticuerpos anti-RhD y la enfermedad hemolítica2). Las causas inmunes están relacionadas con aloinmunización posterior a la exposición materna a antígenos de los glóbulos rojos fetales, formándose anticuerpos maternos y hemólisis fetal. Existen más de 50 antígenos asociados a hemólisis fetal; sin embargo, la anemia fetal grave está relacionada con aloinmunización tipo Rhesus (Rh)D, Rhc o Kell(3; 4).
Los intentos de manejo intrauterino son atribuidos a Bevis en Inglaterra y Liley en Nueva Zelanda. Ambos analizaron el contenido de bilirrubina en líquido amniótico para determinar la posibilidad de muerte fetal inminente debido a anemia hemolítica(5; 6). Así mismo, Bevis intentó la primera transfusión fetal inyectando sangre directamente a la placenta con resultados no alentadores. Es a Liley a quien se le atribuye la primera transfusión intraperitoneal exitosa con un recién nacido de 34 semanas después de dos transfusiones intraperitoneales7.
En 1981, Rodeck comunicó la primera transfusión intravascular exitosa, con el uso de un fetoscopio hacia la inserción placentaria de la vena umbilical8. Y Bang, en 1982, realizó la primera transfusión intravascular guiada por ecografía hacia la porción intrahepática de la vena umbilical9. Publicaciones posteriores mencionan que el acceso a la porción intrahepática de la vena umbilical para muestra de sangre fetal o transfusiones era la más segura10, además que la utilización de agentes paralizantes en el feto contribuía a mejorar el éxito del procedimiento4. Estos importantes avances ayudaron a mejorar la supervivencia neonatal, entre 80 y 90%11).
Una de las primeras publicaciones sobre el empleo de la transfusión intracardiaca fue la de Westgren y col., en 199812. Los investigadores concluyeron que, a pesar de las complicaciones en este tipo de procedimientos, la transfusión intracardiaca es factible cuando la vía intravascular es de difícil acceso.
Metodología
Se realizó un estudio de series de tiempo transversal analítico en donde se obtuvo datos registrados de transfusiones sanguíneas intrauterinas, especialmente de transfusiones intracardiacas fetales.
En el presente artículo presentamos el primer caso en nuestro medio de transfusión intracardiaca en un feto con anemia severa por isoinmunización Rh, el cual tuvo un manejo exhaustivo y difícil, pero con una excelente evolución fetal, neonatal y posnatal (figura 1).
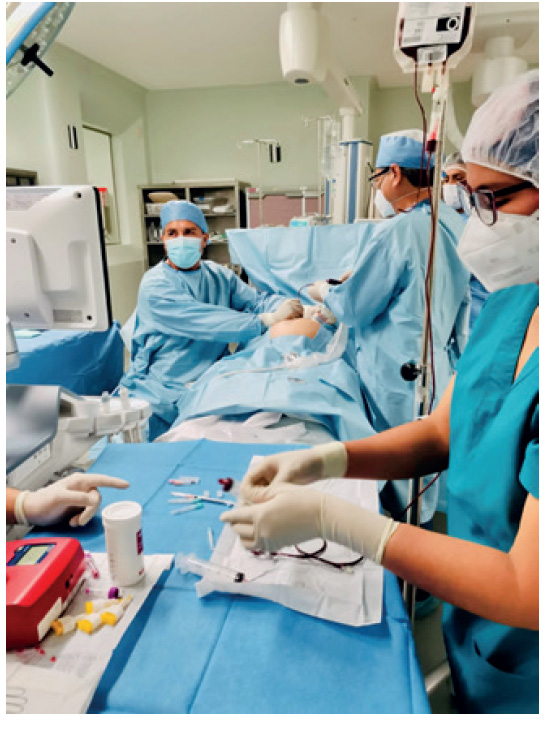
Figura 1 Equipo multidisciplinario en la transfusión sanguínea cardiaca fetal (cirujano fetal, médico fetal, hematóloga, anestesiólogo).
Caso Clínico
Una paciente de 38 años ingresó al centro clínico procedente de Ecuador con una gestación de 25 semanas 3 días y con diagnóstico de isoinmunización Rh. Tenía antecedente de dos hijos nacidos por cesárea; el último cursó con anemia hemolítica e ictericia neonatal a pesar de la aplicación de la vacuna anti D.
En el embarazo actual, se observó al feto con ascitis severa y derrame pericárdico durante la evaluación ecográfica. Se solicitó estudio inmunohematológico a la madre, el cual reveló grupo sanguíneo A, factor Rh negativo, fenotipos C-, E-, c+, e+, K-, k+, Kpa-, Kpb+, Fya+, Fyb+, Jka-, Jkb+,Lea-, Leb+, S+, s+, M+, N-, P1+, Lua-, Lub+. El rastreo de anticuerpos anti-D fue 1/256.
Luego de las evaluaciones y de haber catalogado al feto con hidropesía fetal por anemia severa debido a isoinmunización Rh y bradicardia fetal, se explicó a los padres la severidad del cuadro clínico y la necesidad de una transfusión sanguínea fetal de emergencia.
Se programó la primera transfusión sanguínea a las 48 horas de la primera evaluación. Previamente al procedimiento, se observó dificultad para el abordaje de la vena umbilical a nivel placentario y asa libre mediante la evaluación ecográfica, debido al gran aumento del volumen placentario (placentomegalia) secundario a la anemia fetal severa. Se decidió realizar la transfusión por cardiocentesis a nivel del ventrículo derecho, utilizando una aguja de 21 gauge de 15 centímetros de longitud. Posterior a la inserción de la aguja en el corazón fetal se obtuvo 0,5 mililitros (mL) de sangre para análisis de hemoglobina (Hb) y estudio de grupo sanguíneo. La lectura de la Hb fetal fue de 3,5 g/dL.
Se procedió a transfundir 39 mL de paquete globular O (-) fresco, leucorreducido, irradiado, lavado y concentrado con hematocrito al 80%. La Hb post transfusión resultó en 11.6 mg/dL. El grupo sanguíneo fetal detectado en la muestra de sangre fue A (+). El procedimiento se realizó sin complicaciones y se decidió el alta al día siguiente, con indicación de progesterona micronizada por vía vaginal.
El control ecográfico realizado a los 3 días posteriores al procedimiento reveló un feto de 25 semanas 6 días, sexo femenino, peso de 1,127 gramos, con edema subcutáneo, ascitis fetal, efusión pericárdica, líquido amniótico aumentado en volumen y placenta aumentada de tamaño. Se observó además cardiomegalia y reflujo tricuspídeo. El índice de pulsatilidad de los diferentes vasos evaluados en la ecografía Doppler se encontraban conservados y la velocidad de pico sistólico (VPS) de la arteria cerebral media (ACM) fue de 57,7 cm/seg (mayor a 1,5 múltiplos de la mediana (MoM)). Se decidió nueva transfusión a los 8 días de haber realizado el primer procedimiento.
La segunda y tercera transfusiones se realizaron a las 26 semanas 4 días y a las 30 semanas de gestación, respectivamente, vía transplacentaria por la vena umbilical, sin complicaciones. Las evaluaciones ecográficas efectuadas semanalmente mostraron una mejoría fetal evidente, con disminución de la ascitis y del derrame pericárdico. El Doppler fetal se halló en valores adecuados y la VPS ACM por debajo de 1,5 MoM.
Se decidió realizar junta médica a la edad gestacional de 33 semanas 2 días para valorar el manejo posterior del caso, teniendo en cuenta las 3 transfusiones sanguíneas realizadas, una de ellas por cardiocentesis, con buena evolución fetal; además, había el antecedente de dos cesáreas anteriores. Se decidió programar una cuarta transfusión intrauterina a las 34 semanas 0 días, cuyo objetivo fue dejar una Hb post transfusión de 16 g/dL y programar el término de la gestación a las 36 semanas, aplicando previamente un curso completo de maduración pulmonar previa a la transfusión intrauterina.
La cuarta transfusión sanguínea fetal se realizó a las 34 semanas 0 días según lo programado, vía vena umbilical en su inserción placentaria sin complicaciones, y la cesárea programada se realizó finalmente a las 34 semanas 6 días, por dolor en zona de cicatriz operatoria anterior y evidencia de adelgazamiento del segmento uterino por ecografía, hallazgo que se corroboró en el acto operatorio.
Se obtuvo un recién nacido de sexo femenino, con peso de 2,580 gramos, talla 41 centímetros, Apgar 6 al minuto y 9 a los 5 minutos, líquido amniótico amarillo. Se observó llanto débil, pobre esfuerzo respiratorio y retracción subcostal en el recién nacido. Se procedió a ventilar con bolsa y máscara de Venturi con FiO2 0,21, recuperando el esfuerzo respiratorio. Sin embargo, se decidió el uso de presión positiva continua en la vía aérea (CPAP, por sus siglas en inglés), mejorando así la dificultad respiratoria.
En las horas siguientes se realizó cateterismo de vasos arterial y venoso umbilicales y se solicitó exámenes de laboratorio, los cuales evidenciaron valores de bilirrubina que indicaron realizar exanguinotransfusión.
La primera se realizó a las 7 horas de vida. Se indicó 20 recambios de 20 mL cada uno para un total de 400 mL. El procedimiento se efectuó sin complicaciones y se indicó luego fototerapia intensiva.
A pesar del procedimiento, las bilirrubinas siguieron en rango de exanguinotransfusión, por lo que se decidió practicar un segundo procedimiento a las 20 horas de vida, el cual se realizó con sangre reconstituida O (-), 19 recambios para un volumen aproximado de 388 mL, sin complicaciones. La recién nacida continuó en CPAP y fototerapia intensiva. En los controles siguientes, los resultados de bilirrubinas resultaron aún en valores para exanguinotransfusión y se decidió realizar una tercera exanguinotransfusión a las 30 horas de vida, con recambio de 340 mL.
Durante la estancia hospitalaria, la evaluación cardiológica evidenció hipertrofia ventricular izquierda con función biventricular conservada. La evaluación por nefrología constató una insuficiencia renal aguda no oligúrica, mostrando en la ecografía renal una nefropatía inespecífica con mala diferenciación corticomedular. La ecografía Doppler renal evidenció alteración en los flujos, sugiriéndose evitar fármacos que condicionaran nefrotoxicidad y controles continuos de la función renal cada 48 horas.
Neuropediatría evidenció signos clínicos de encefalopatía por hiperbilirrubinemia aguda que ameritaban seguimiento y evaluación de compromiso auditivo con potenciales evocados del tronco cerebral e intervención temprana con terapia física.
La evolución de la recién nacida posterior a la tercera exanguinotransfusión fue óptima. A los 6 días de vida se retiró el CPAP y quedó con cánula binasal con buena tolerancia, la cual al día siguiente fue retirada, quedando con respiración espontánea sin requerimiento de oxígeno. Igualmente, los rangos de bilirrubinas fueron en descenso, lo que permitió el retiro de la fototerapia. Con relación a la parte nutricional, a los 5 días de vida se inició nutrición parenteral total, después de 4 días de ayuno, y a los 6 días de vida se realizó tolerancia oral con buena respuesta. A los 8 días de vida se inició lactancia materna directa además de la nutrición parenteral, con buena respuesta. Y a los 9 días se suspendió la nutrición parenteral para quedar solo con lactancia materna exclusiva. Se observó dificultad para la succión en los días posteriores, por lo que medicina física y rehabilitación inició terapia de succión. A los 13 días de vida fue trasladada de la incubadora a la cuneta y se inició contacto piel a piel. Se observó además una mejora en la alimentación vía oral con ayuda de la terapia física. Finalmente, se decidió el alta a los 25 días posteriores al nacimiento, en buenas condiciones.
En su último control, ya con 18 meses de vida, las evaluaciones de la niña han resultado óptimas y su estado de salud es satisfactorio.
Discusión
El presente es el primer caso exitoso de transfusión intracardiaca fetal por anemia severa debido a isoinmunización Rh publicado en nuestro país. El cuadro clínico fetal severo llevó a realizar esta primera transfusión intracardiaca de emergencia, debido a la bradicardia severa y la dificultad en el acceso a la vena umbilical vía transplacentaria por la placentomegalia secundaria a la anemia fetal.
Las transfusiones requeridas posteriormente se efectuaron vía transplacentaria en la vena umbilical por la mejora clínica progresiva del feto.
Las vías de abordaje de transfusión intrauterina suelen ser por la vena umbilical a nivel de la inserción placentaria del cordón, en asa libre de cordón o a nivel de la porción intrahepática. Sin embargo, se describe también el abordaje intracardiaco fetal, que tiene la ventaja de ser un objetivo más grande que el acceso venoso a nivel del cordón o intrahepático, pero con riesgo de producir sangrado y taponamiento cardiaco secundario.
El objetivo de la transfusión es reemplazar la sangre fetal con sangre de donante Rh negativo, suprimiendo así la eritropoyesis fetal, permitiendo además mejorar el estado hemodinámico fetal para continuar el embarazo hasta que el feto sea viable (idealmente 36 semanas) y prevenir la muerte fetal. En el presente caso, además de mejorar la supervivencia y pronóstico fetal, ayudó mucho al soporte neonatal. Para la transfusión es importante tener en cuenta utilizar glóbulos rojos frescos, tamizados para estar libre de virus, leucorreducidos, irradiados, tipo O, Rh D-negativo, cruzados con una muestra materna y empaquetados con un hematocrito de 75 a 80%. La sangre materna autóloga lavada también se puede usar, lo que elimina el riesgo de sensibilización a nuevos antígenos de glóbulos rojos en la sangre de donantes aleatorios(13; 14).
El acceso intracardiaco para la transfusión intrauterina o muestreo sanguíneo fetal no señala tasas de éxito en las series de casos publicadas, pero sí una tasa de complicaciones de 5,6% a 6,5%. Las complicaciones informadas en este tipo de procedimiento son similares a las descritas anteriormente, además de hemopericardio, daño en las válvulas auriculo-ventriculares, daño auricular, en los grandes vasos, en el sistema de conducción e incluso puede haber trauma pulmonar15.
La técnica recomendada para realizar una transfusión intracardiaca requiere, como para todos los procedimientos intrauterinos, una adecuada consejería a la madre de la paciente para que pueda entender los beneficios de tener un acceso más grande y directo al sistema cardiovascular comparativamente al acceso venoso umbilical; y también los riesgos relacionados con el procedimiento y probable trauma cardiaco. Por ello se propone dar opciones a los padres de otros procedimientos alternativos e inclusive la posibilidad de elegir la no intervención mediante consentimiento informado16.
Se recomienda la entrada por el ventrículo derecho por ser el camino más corto y reducir el daño al sistema de conducción ventricular. Se debe tener cuidado de no dañar las válvulas auriculo-ventriculares, los grandes vasos y otras estructuras como pulmón e hígado. La aguja a utilizar debe ser larga y delgada, de 21, 22 o 24 gauge, tanto para acceder con facilidad al tórax fetal y limitar el tamaño de la punción. Después de insertar la aguja en el líquido amniótico, ingresar con la aguja perpendicular a la pared torácica para reducir la posibilidad de que el cuerpo fetal ruede durante la punción inicial y luego colocar la aguja dentro del ventrículo derecho. Luego de confirmar que la punta de la aguja se encuentra dentro del ventrículo derecho, se debe tener cuidado de no penetrar el tabique interventricular o dañar las válvulas auriculoventriculares. La transfusión debe realizarse a través de un sistema cerrado para evitar la embolia gaseosa a través del conducto arterioso hacia la circulación sistémica fetal. Antes de retirar la aguja, se debe controlar la frecuencia cardíaca fetal y observar el espacio pericárdico, y si no existen complicaciones, retirar la aguja con mucho cuidado. Se sugiere el monitoreo electrónico de la frecuencia cardíaca fetal posterior al procedimiento para excluir evidencia de una condición fetal no tranquilizadora o el inicio de la actividad uterina y evaluación ecográfica de seguimiento dentro de las 24 horas posteriores al procedimiento15.
Mackie y col(17). reportaron una serie de 8 fetos a quienes realizaron transfusión intracardiaca fetal, de un total de 105 gestantes que recibieron transfusión intrauterina en 10 años. Las edades gestaciones fluctuaron entre las 17 a 21 semanas, la mayoría de las gestantes (6 de 8) tenían un IMC >= 35 kg/m2 y todos los fetos estaban hidrópicos. Dos fetos tenían isoinmunización anti-D y uno anti-Kell. Los 5 fetos restantes tuvieron anemia severa por Parvovirus B-19. Dos fetos infectados por Parvovirus B19 fallecieron por anemia y trombocitopenia severa además de compromiso miocárdico severo. Las complicaciones presentadas durante el procedimiento fueron bradicardia severa y asistolia, colocación inadvertida de la aguja en la válvula mitral y hemopericardio.
Las complicaciones observadas por este procedimiento pueden ser algunas veces manejadas. Westgren et al12, comunicaron la reanimación intrauterina exitosa de 2 fetos con bradicardia intraoperatoria mediante la instilación intracardíaca directa de epinefrina y también informaron una pericardiocentesis exitosa después de una entrada inadvertida en la aurícula derecha, lo que aparentemente provocó una hemorragia en el espacio pericárdico.
Un estudio realizado a nivel global permitió descubrir que existe una brecha de más del 80% de dosis anuales de Ig anti-Rh(D) no administrados a las pacientes que lo requirieron en varios países latinoamericanos como el nuestro18.
Llama también la atención que esta paciente con inmunoprofilaxis aplicada previamente, tuviera problemas de anemia hemolítica neonatal en el segundo embarazo e hidrops fetal temprano. Se comunica que en el 1,8% de las mujeres Rh negativas sin evidencia clínica de isoinmunización y que reciben inmunoprofilaxis con vacuna anti-D post parto, la profilaxis no funciona, problema que pudo haber existido en esta paciente19.
Conclusiones
Este caso presentado nos ha permitido tener la experiencia de realizar una transfusión sanguínea intracardiaca en un feto severamente complicado por isoinmunización Rh y reportarla como un recurso válido de una vía de acceso adicional en casos severos que lo requieran.
La evolución fetal y neonatal nos sirve de guía para el manejo de fetos complicados con anemia severa. Además, no dejamos de aprender que mientras más temprano detectemos el problema, mejor es el pronóstico fetal y neonatal, sin dejar de lado que la inmunoprofilaxis es el arma principal.
Referencias Bibliográficas
1. Diamond LE, Blackfan K, Baty JM. Erythroblastosis fetalis and its association with universal edema of the fetus, icterus gravis neonatorium and anemia of the newborn. J Pediatr. 1932;1:269-309. [ Links ]
2. Levine P, Katzin EM, Burham L. Isoinmunization in pregnancy: its possible bearing on etiology of erythroblastosis foetalis. JAMA. 1941;116:825-27. [ Links ]
3. Moise KJ. Fetal anemia due to non-Rhesus D red cell alloinmunization. Semin Fetal Neonatal Med. 2008;13:207-14. doi: 10.1016/j.siny.2008.02.007 [ Links ]
4. Moise KJ Jr, Deter RL, Kirshon B, Adam K, Patton DE, Carpenter RJ Jr. Intravenous pancuronium bromide for fetal neuromuscular blockade during intrauterine transfusion for red-cell alloinmunization . Obstet Gynecol. 1989;74:905-08. PMID: 2586956 [ Links ]
5. Bevis DC. Blood pigments in haemolytic disease of the newborn. J Obstet Gynaecol Br Emp. 1956;63:68-75. doi: 10.1111/j.1471-0528.1956.tb05435.x [ Links ]
6. Liley AW. Liquor amnil analysis in the management of the pregnancy complicated by resus sensitization. Am J Obstet Gynecol. 1961;82:1359-70. doi: 10.1016/s0002-9378(16)36265-2 [ Links ]
7. Liley AW. Intrauterine transfusion of foetus in haemolytic disease. Brit Med J. 1963;2:1107-9. doi: 10.1136/bmj.2.5365.1107 [ Links ]
8. Rodeck CH, Kemp JR, Holman CA, Whitmore DN, Karnicki J, Austin MA. Direct intravascular fetal blood transfusion by fetoscopy in severe Rhesus isoinmunisation. Lancet. 1981;1:625-7. doi: 10.1016/s0140-6736(81)91549-x [ Links ]
9. Bang J, Bock JE, Trolle D. Ultrasound-guided fetal intravenous transfusion for severe rhesus haemolytic disease. Brit Med J. 1982;284:373-4. doi: 10.1136/bmj.284.6313.373 [ Links ]
10. Nicolini U, Santolaya J, Ojo OE. The fetal intrahepatic umbilical vein as an alternative to cord needling for prenatal diagnosis and therapy. Prenatal Diagn. 1988;8:665-71. doi: 10.1002/pd.1970080906 [ Links ]
11. Linderburg IT, van Kamp IL, van Zwet EW, Middeldorp JM, Klumper FJ, Oepkes D. Increased perinatal loss after intrauterine transfusion for alloinmune anaemia before 20 weeks of gestation. BJOG. 2013;120:847-52. doi: 10.1111/14710528.12063 [ Links ]
12. Westgren M, Selbing A, Syangenberg M. Fetal intracardiac transfusion in patients with severe rhesus isoinmunization. BMJ. 1988;296:885-6. doi: 10.1136/bmj.296.6626.885 [ Links ]
13. Moise KJ. Red blood cell alloinmunization in pregnancy. Semin Hematol. 2005;42:169-78. doi: 10.1053/j.seminhematol.2005.04.007 [ Links ]
14. Huertas E. Anemia fetal, diagnostico y manejo actual. Rev Peru Ginecol Obstet. 2019;65:511-7. http://dx.doi.org/10.31403/rpgo.v65i2211 [ Links ]
15. Sarno AP Jr, Wilson RD. Fetal cardiocentesis: a review of indications, risks, applications and technique. Fetal Diagn Ther. 2008;23(3):237-44. doi: 10.1159/000116748 [ Links ]
16. Chervanak FA, McCullough LB. Ethical issues in recommending and offering fetal therapy. West J Med. 1993;159:369-99. PMID: 11643180 [ Links ]
17. Fiona L. Mackie, Samantha J. Pretlove, William L. Martin, Veronica Donovan, Mark D. Kilby. Fetal intracardiac transfusion in hydropic fetuses with severe anemia. Fetal Diagn Ther. 2015;38:61-4. doi: 10.1159/000369798 [ Links ]
18. Pegoraro V, Urbinati D, Visser GHA, Di Renzo GC, Zipursky A, Stotler BA, et al. Hemolytic disease of the fetus and newborn due to Rh(D) incompatibility: A preventable disease that still produces significant morbidity and mortality in children. PLoS ONE. 2020 July:15. doi: 10.1371/journal.pone.0235807 [ Links ]
19. Bowman J. Rh-immunoglobulin: Rh prophylaxis. Best Pract Res Clin Haemat. 2006;19:27-34. doi: 10.1016/j.beha.2005.03.003 [ Links ]
留言 (0)