Caso Clínico
Manejo conservador en hemorragia puerperal por placenta acreta
Gloria Paz Martínez Ramón1 , Médico Residente de Ginecología y Obstetricia
Alba González Sevilla1 , Médico Residente de Ginecología y Obstetricia
José Félix García Fernández1 , Médico Especialista en Ginecología y Obstetricia
Maite Cortés Antolín1 , Médico Residente de Ginecología y Obstetricia
Andrea Gutiérrez Landaluce1 , Médico Residente de Ginecología y Obstetricia
María Román Maseres1 , Médico Residente de Ginecología y Obstetricia
1Hospital San Pedro, Logroño, La Rioja, España
El espectro placenta acreta se encuentra en incremento debido a múltiples causas, especialmente por el aumento de las cesáreas. El diagnóstico supone un reto, pues la mayoría de casos se asocia a hemorragia tras el alumbramiento. La ecografía morfológica prenatal debe valorar signos que hagan sospechar acretismo placentario. Se presenta el caso de una paciente diagnosticada de placenta acreta luego de abundante hemorragia puerperal 48 horas después del alumbramiento que requirió dos legrados uterinos y la administración de metotrexato intramuscular. En cuanto al tratamiento, aunque anteriormente se optaba por el manejo radical, la tendencia actual es un manejo conservador con el fin de preservar la fertilidad de la paciente.
Palabras clave: Placenta accreta; Tratamiento conservador
INTRODUCCIÓN
El espectro placenta acreta es una patología poco frecuente, pero su incidencia va en aumento 1). Esta placentación anómala se clasifica clásicamente en 3 tipos. La placenta acreta consiste en la invasión del miometrio por tejido trofoblástico. La invasión miometrial profunda se conoce como placenta íncreta. Y en la placenta percreta, la penetración se extiende más allá de la serosa uterina, invadiendo incluso órganos vecinos. Además, según la extensión lateral, se le subdivide en focal, parcial y total, en función del número de cotiledones implicados.
La penetración de la placenta en el miometrio tiene como consecuencia clínica que la placenta no se separe del útero durante la tercera etapa del parto, lo que provoca una hemorragia grave posparto 2). El diagnóstico precoz es un reto para evitar hemorragias masivas en el alumbramiento en casos no diagnosticados con anterioridad al parto.
CASO CLÍNICO
La paciente atendida fue una primigesta de 33 años sin antecedentes médico-quirúrgicos de interés, con gestación controlada y sin factores de riesgo. En las ecografías realizadas durante el embarazo, la placenta estaba localizada en la cara posterior y fúndica y no se mencionó signos de espectro placenta acreta. Presentó trabajo de parto espontáneo a las 392/7 semanas de gestación que finalizó con parto instrumental con ventosa tipo Kiwi bajo anestesia epidural, por expulsivo prolongado. Se obtuvo un recién nacido normal, sexo masculino, peso 3,340 gramos, Apgar 9/10 y pH de arteria umbilical 7.30. Tras el alumbramiento, la placenta se desprendió con aparente normalidad y su revisión objetivó que estaba íntegra. Al segundo día previo al alta, se observó altura uterina aumentada a un través de dedo por encima del ombligo, por lo que se le realizó una ecografía en la que se evidenció una imagen compatible con restos ovulares, decidiéndose realizar legrado puerperal bajo control ecográfico. La cavidad uterina quedó aparentemente vacua por ecografía y el material extraído fue compatible con restos placentarios, confirmado por anatomía patológica.
Un mes después del parto inició sangrado uterino abundante estimado en un litro, por lo que se le realizó ecografía en la que se objetivó imagen hiperecogénica de 20 mm compatible con restos placentarios y una imagen hiperecogénica de 37,9 x 34,9 x 24,6 mm en la cara posterior uterina a nivel miometrial, mal definida y con un patrón Doppler color con intensidad media-alta sugestivo de foco de acretismo placentario (figura 1). Por este motivo se le realizó un segundo legrado, se colocó taponamiento uterino y se indicó fármacos uterotónicos.
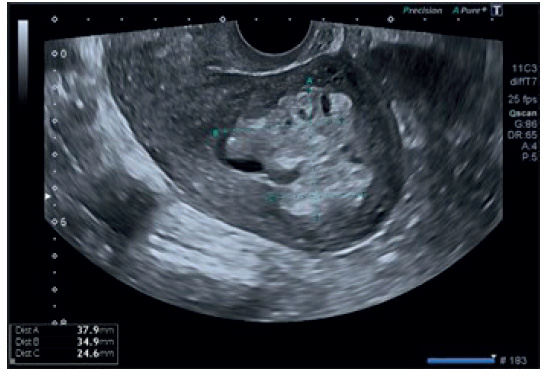
Figura 1 Imagen ecográfica en la que se visualiza el útero con una formación hiperrefringente de 37,9 x 34,9 x 24,6 mm que corres
Al día siguiente se retiró dicho taponamiento y no se objetivó sangrado. Una nueva ecografía describió el útero en retroversión, de 85 x 65 mm, puerperal y bien involucionado, línea endometrial con puntos hiperrefringentes secundarios a legrado. Imagen ecogénica intramiometrial de 73 x 52 mm con mapa color en su interior compatible con acretismo placentario (figura 2).
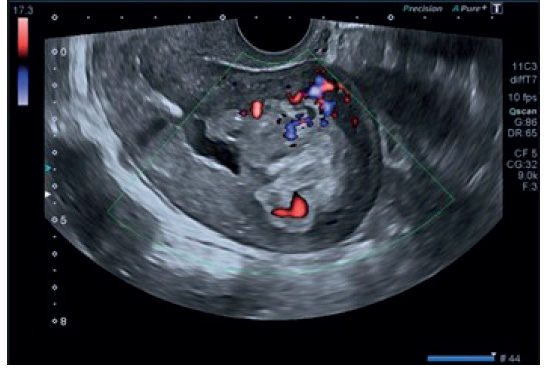
Figura 2 Imagen ecográfica en la que se visualiza formación hiperrefringente con invasión miometrial; el Doppler pulsado indicó abundante vascularización.
La paciente fue informada de los hallazgos y de la posibilidad de recurrir a una histerectomía si se presentase una hemorragia severa.
Para completar el estudio, se solicitó histeroscopia diagnóstica 72 horas después del segundo legrado, que informó de cavidad uterina ocupada por material desflecado principalmente intramiometrial que llegaba a cavidad desde la cara anterior, compatible con restos placentarios. Se tomó una muestra para biopsia que fue informada como restos deciduocoriales con marcados cambios degenerativos e inflamación aguda.
Estos datos fueron comunicados a la paciente, quien manifestó el deseo de conservar el útero y de ser posible intentar un manejo conservador. Se e señaló el riesgo de infección y de sangrado. A pesar de ello, la paciente expresó su deseo de manejo conservador, por lo que se decidió administrar dosis única de metotrexato 79,5 mg IM (por fórmula Mosteller). Además, se ofreció la posibilidad de frenación ovárica que la paciente consintió, administrándose una dosis de un análogo de la hormona liberadora de gonadotropinas -triptorelina (Decapeptyl) 11,25 IM- y un antagonista de la hormona liberadora de gonadotropinas, orgalutran (Ganirelix) a dosis de 0,25 mg diaria durante 5 días.
La paciente fue dada de alta asintomática. En la ecografía de control seis meses después se siguió describiendo la imagen intramiometrial con un tamaño de 7 x 9 mm sin captación Doppler. Es decir, mejoría muy significativa con respecto al cuadro inicial. (figura 3). Debido a lo anterior, se decidió usar un gestágeno (acetato de medroxiprogesterona, Progevera) en pauta continua.
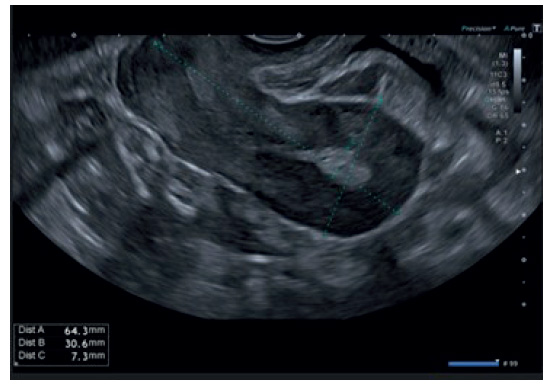
Figura 3 Imagen ecográfica en la que se visualiza un útero de morfología y tamaño normal. Formación hiperrefringente de 7,3 mm en fondo uterino, disminución considerable del tamaño con respecto a ecografías anteriores
Actualmente la paciente se encuentra en amenorrea y sin deseo genésico.
DISCUSIÓN
El espectro placenta acreta es una patología que está en aumento debido, sobre todo, al incremento de cesáreas. También puede deberse a multiparidad, edad reproductiva avanzada, endometriosis, dilatación y legrado uterino, miomectomías convencionales y resecciones histeroscópicas de septos y miomas 3). Además, uno de los principales factores de riesgo es la combinación de cesárea anterior y placenta previa, lo que aumenta el riesgo exponencialmente. Otras causas menos frecuentes serían las endometritis secundarias a enfermedad inflamatoria pélvica por enfermedades de transmisión sexual, unido al aumento de anticoncepción con dispositivos intrauterinos.
En cuanto al diagnóstico, puede sospecharse en pacientes previamente intervenidas para tratar afecciones uterinas por causa obstétrica, ginecológica u otra 4). Y, aunque podría ser diagnosticada durante la ecografía morfológica, es muy frecuente que el diagnóstico se produzca en la hemorragia posparto tras el alumbramiento.
Los signos ecográficos que podrían indicar la presencia de placentación anómala serían: adelgazamiento de la interfase útero-placenta sin ver límites claros, lagunas anecoicas y flujo sanguíneo turbulento. Por ello, durante la ecografía del segundo trimestre, además de ver la morfología fetal, se debe evaluar la morfología placentaria y no solo su localización uterina. También podría utilizarse la resonancia magnética con o sin gadolinio para mejorar el diagnóstico prenatal, siendo esta complementaria a la ecografía en casos aislados. Si comparamos la ecografía y la resonancia magnética con gadolinio, se encuentra alta sensibilidad (77% y 88%, respectivamente) y alta especificidad (96% y 100%, respectivamente), para ambas modalidades 3).
El diagnóstico de confirmación nos lo da la anatomía patológica. El estándar de oro sería la ausencia de decidua basal, lo que no siempre se halla por la distorsión que ocurre en el momento del alumbramiento, salvo en los casos de histerectomía 5).
Por lo expuesto, en más del 50% de las ocasiones el diagnóstico de placentación anómala se hace en el contexto de sangrado puerperal masivo tras el alumbramiento que podría incluso producir choque hipovolémico, coagulación intravascular diseminada y el fallecimiento de la paciente.
En cuanto al tratamiento, clásicamente se ha optado por el manejo quirúrgico mediante histerectomía total abdominal. Sin embargo, en los últimos años ha surgido una corriente conservadora que evita la histerectomía y sus complicaciones y busca preservar la fertilidad futura de las pacientes 5). Entre los tratamientos conservadores está la embolización de las arterias uterinas o la resección histeroscópica del área afectada del útero 3), aunque estos tratamientos pueden interferir posteriormente en la fertilidad. Otra medida menos invasiva sería la administración de metotrexato que acelera la resorción placentaria, implementada en nuestro caso con buena evolución de la paciente.
Se puede observar que el tratamiento de la implantación anormal placentaria es variado y aún no se ha consensuado la pauta a seguir. Se decidiría en función de cada caso, de la estabilidad de la paciente y de la cantidad de sangrado. La medida más radical sería la histerectomía en casos de sangrado abundante e inestabilidad de la paciente. Se intentará una medida más conservadora cuando la paciente es primigesta.
REFERENCIAS
1. Tantbirojn P, Saleemuddin A, Sirois K, Crum CP, Boyd TK, Tworoger S, Parast MM. Gross abnormalities of the umbilical cord: related placental histology and clinical significance. Placenta. 2009;30(12):1083-8. DOI: 10.1016/.placenta.2009.09.005 2. Stanek J. Association of coexisting morphological umbilical cord abnormality and clinical cord compromise with hypoxic and thrombotic placental histology. Virchows Arch. 2016;468(6):723-32. DOI: 10.1007/s00428-016-1921-1 [ Links ]
3. Bergman P, Lundin P, Malmstrom T. Mucoid degeneration of Wharton's jelly: An umbilical cord anomaly threatening fetal life. Acta Obstet Gynecol Scand. 1961;40:372-8. DOI: 10.3109/00016346109159935 [ Links ]
4. Thomson LL, Hoo JJ. Linear disruption of umbilical cord: a rare anomaly of the cord associated with acute fetal distress and perinatal death/profound psychomotor retardation. Am J Med Genetics. 1996;62:348-9. DOI: 10.1002/(SICI)1096- 8628(19960424)62:43.0.CO;2-N [ Links ]
5. Labarrere C, Sebastiani M, Siminovich M, Torassa E, Althabe 0. Absence of Wharton's jelly around the umbilical arteries: An unusual cause of perinatal mortality. Placenta. 1985:555-9. DOI: 10.1016/s0143-4004(85)80010-2 [ Links ]
6. Trivedi S, Ratanoo L, Purohit S, Rastogi P. Absence of Wharton's jelly: an association with feto-maternal morbidity. Int J Reprod Contracept Obstet Gynecol. 2020 Mar;9(3):1318-20. DOI: https://doi.org/10.18203/2320-1770.ijrcog20200926 [ Links ]
7. Benirschke K, Kauffmann P, Baergen RA. Pathology of Human Placenta. Fifth edition. 2006: pag. 381. Springer New York, NY. DOI: https://doi.org/10.1007/b137920 [ Links ]
8. Nanaev AK, Kohnen G, Milovanov AP, Domogatsky SP, Kaufmann P. Stromal differentiation and architecture of the human umbilical cord. Placenta. 1997;18(1):53-64. DOI: 10.1016/ s0143-4004(97)90071-0 [ Links ]
9. Takechi K, Kuwabane Y, Mizuna M. Ultrastructural and Immunohistochemical Studies of Wharton's Jelly Umbilical Cord Cells. Placenta. 1993;14:235-45. [ Links ]
10. Cole J, Israfil-Bayli F. Wharton's jelly: The significance of absence. J Obstet Gynaecol. 2016 May;36(4):500-1. DOI: 10.3109/01443615.2015.1094041 [ Links ]
11. Kulkarni M, Matadh P, Achok C, Pradeep N, Avinash T, Kulkarni A. Absence of Wharton's Jelly around the umbilical arteries. Indian J Pediatr. 2007;74(8):787-9. DOI: 10.1007/s12098-007- 0142-7 [ Links ]
12. Murphy SJ, Deegan N, O'Leary BD, McParland P. absence of Wharton's jelly. BMJ Case Rep 2020;13:e237222. doi:10.1136/ bcr-2020- 237222 [ Links ]
13. Oliveira CC, Dufloth RM, Coelho KR. Absence of Wharton's jelly: case report. J Bras Patol Med Lab. 2014;50(6):452-5. [ Links ]
14. Botezatu R.; Raduteanu S, Ciobanu AM, Gica N, Peltecu G, Panaitescu AM. Absence of Wharton's Jelly at the Abdominal Site of the Umbilical Cord Insertion. Rare Case Report and Review of the Literature. Medicina. 2021;57:1268. https://doi.org/10.3390/medicina57111268 [ Links ]
15. Wade M, Gueye M, Mbodji A, Ndiaye MD. Absence of Wharton's jelly around an umbilical artery. Int J Reprod Contracept Obstet Gynecol. 2022;11:259-61. DOI: https://dx.doi.org/10.18203/2320-1770.ijrcog20215115 [ Links ]
16. Damasceno EB, de Lima PP. Wharton's jelly absence: a possible cause of stillbirth. Autops Case Rep. 2013 Dec 31;3(4):43-7. doi: 10.4322/acr.2013.038. PMID: 28584806; PMCID: PMC5453660. [ Links ]
留言 (0)