Artículos Originales
Restricción de crecimiento intrauterino según curvas personalizadas peruanas: estudio de validación y precisión diagnóstica
Oswaldo Tipiani-Rodríguez1
, Médico gineco-obstetra, Maestro en Gerencia de Servicios de Salud. Unidad de Medicina Materno Fetal http://orcid.org/0000-0002-1325-7249
http://orcid.org/0000-0002-1325-7249
Yuliana Libet Bocanegra-Becerra1
, Médico gineco-obstetra, Servicio de Obstetricia Médica http://orcid.org/0000-0003-4566-4516
http://orcid.org/0000-0003-4566-4516
Cristopher Huarag-Chavarry1
, Médico gineco-obstetra, Servicio de Obstetricia Médica http://orcid.org/0000-0003-4363-4567
http://orcid.org/0000-0003-4363-4567
Kristtel Figueroa-Morales1
, Médico gineco-obstetra, Servicio de Obstetricia Médica http://orcid.org/0000-0002-8284-2193
http://orcid.org/0000-0002-8284-2193
Miguel Ángel PoncianoBiaggi1
, Médico gineco-obstetra, Servicio de Obstetricia Médica http://orcid.org/0000-0002-1479-234X
http://orcid.org/0000-0002-1479-234X
1Departamento de Gineco Obstetricia, Hospital Nacional Alberto Sabogal Sologuren, EsSalud, Lima, Perú
No existe consenso sobre la curva de crecimiento a utilizar para evaluar el crecimiento fetal. Validar unas curvas personalizadas y estudiar su rendimiento en la detección de neonatos con restricción de crecimiento intrauterino (RCIU), así como su precisión diagnóstica. Inicialmente se diseñó unas curvas personalizadas con 2,792 fetos únicos de embarazos de riesgo bajo; se calculó el peso óptimo a las 40 semanas = 1,496.202 + (64.379 x sexo fetal) + (831.362 x talla materna) + (9.567 x peso pregestacional), ecuación que se combinó con una función de proporcionalidad estándar para ajustar los pesos según su edad gestacional. Posteriormente se evaluó su rendimiento aplicándola en una cohorte retrospectiva de neonatos de 24 a 40 semanas nacidos entre 2018 y 2022 en un hospital de tercer nivel de Lima, Perú. Se excluyeron gemelos y anomalías congénitas. Se estudió 6,598 neonatos. Las curvas personalizadas mostraron buena concordancia con INTERGROWTH-21 (IG21) (kappa = 0,68; IC95% = 0,62 a 0,74). Se detectó un 2,8% de RCIU (184/6,598), similar al 3,1% de IG21 (205/6,598). Las curvas mostraron alta especificidad y valor positivo negativo (VPN) (97% y 98%; IC95% = 97 a 98% y 98 a 99%, respectivamente). El riesgo para muerte perinatal (RR =7,2; IC95% = 4,6 a 11) y su exactitud (96; IC95% = 95 a 96%) fueron superiores a los de la Fundación de Medicina Fetal (FMF) (RR = 3,6; IC95% = 2,5 a 5,2 y exactitud = 89%; IC95% = 88 a 89%, respectivamente). Las curvas peruanas personalizadas resultaron fiables para evaluar la RCIU. Su capacidad de detección y su precisión diagnóstica fueron similares a otras curvas internacionales, aunque algo superiores a las de la FMF.
Palabras clave: Atención perinatal; Restricción del crecimiento fetal; Desarrollo fetal; Ultrasonido; Investigación fetal; Mortalidad perinatal
INTRODUCCIÓN
Se denomina restricción de crecimiento intrauterino (RCIU) cuando un feto no puede alcanzar su potencial de crecimiento genéticamente determinado 1). La importancia de su detección radica es por su asociación a morbimortalidad feto-neonatal 1). Según las recomendaciones de la Sociedad Internacional de Ultrasonido en Obstetricia y Ginecología (ISUOG, por sus siglas en inglés), se diagnostica una RCIU cuando el peso o la circunferencia abdominal fetal medidos ecográficamente están por debajo del percentil 31). Sin embargo, la determinación de este percentil depende de la curva o tabla de crecimiento fetal que se utilice, existiendo discrepancia entre los resultados 2).
Desde décadas pasadas se han diseñado tablas de referencia, como la de Hadlock, la cual fue realizada con población de raza blanca en E.E. U.U. 3), la de la Fundación de Medicina Fetal (FMF), tabla inglesa con población mayoritariamente blanca 4), o el estándar de crecimiento de la Organización Mundial de la Salud (OMS) diseñado con mujeres de bajo riesgo para expresar el crecimiento normal de un feto en condiciones óptimas 5). El proyecto Intergrowth-21st difiere del anterior por no usar la longitud de fémur en el cálculo del peso fetal 6), mientras que el Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver (NICHD) desarrolló tablas para etnias específicas sin ajustar por otros factores 7). Existen además curvas de crecimiento personalizadas, cuyas fórmulas incluyen características maternas y fetales como la talla, peso pregestacional, paridad y sexo fetal. Varios estudios han justificado su uso 8-10), pero otros no están de acuerdo con estas consideraciones 11,12). Por tanto, existe discrepancia entre los médicos sobre cuál de las curvas se deben usar para clasificar el crecimiento fetal 13).
En Perú, se han hecho esfuerzos por diseñar curvas en su población 14,15). Sin embargo, no existen curvas personalizadas validadas, por lo cual en muchos hospitales se usan curvas internacionales, persistiendo la duda sobre si sus resultados reflejan el crecimiento real de los fetos peruanos. Además, no se tiene en claro si las curvas internacionales sobrediagnostican o subestiman fetos peruanos con RCIU. No se tiene información sobre su precisión diagnóstica o rendimiento para predecir muerte perinatal en este país. Tampoco se tiene información sobre si una curva peruana tuviera mayor detección y precisión comparada con las internacionales al aplicarla en su población. Por ello se diseñó en este trabajo unas curvas de crecimiento intrauterino personalizadas con población peruana, que fueron validadas al demostrar su rendimiento en la detección de neonatos con RCIU y su precisión diagnóstica al compararlas con las curvas internacionales más usadas en el mundo.
MÉTODOS
En una primera etapa se construyó un modelo personalizado peruano. La curva de crecimiento personalizada fue desarrollada por uno de los autores (OTR). Se calculó de manera prospectiva los pesos fetales ecográficos de 2,792 fetos de gestantes de bajo riesgo, es decir mujeres que no presentaban hipertensión, preeclampsia, diabetes, anomalías congénitas, rotura prematura de membranas, síntomas de parto pretérmino, restricción del crecimiento intrauterino y que no fueron hospitalizadas durante el embarazo. Ellas fueron atendidas en los hospitales nacionales Alberto Sabogal Sologuren (n=1,350) y Edgardo Rebagliati Martins (n=1,442) de Lima, Perú. Tenían fetos únicos con 40 semanas de gestación (calculadas por ecografía de las 11 0/7 a 13 6/7 semanas). El estudio fue realizado por ginecólogos con más de tres años de experiencia en ultrasonografía, quienes usaron ecógrafos Samsung HS70A. Los pesos fetales fueron calculados en base al diámetro biparietal, perímetro cefálico, circunferencia abdominal y longitud del fémur, de acuerdo con la fórmula de Hadlock 3). Se calculó un peso óptimo a las 40 semanas (280 días) (media = 3,421.8; desviación estándar = 306.5), obteniendo un coeficiente de variación (CV) de 9 %. Luego, se desarrolló una regresión lineal obteniendo la siguiente ecuación de regresión: peso óptimo = 1496.202 + (64.379 x sexo fetal) + (831.362 x talla materna) + (9.567 x peso pregestacional). F = 170.76 p = 0,00 (ANOVA). R2 = 15,5. Asimismo, se combinó la ecuación con una función de proporcionalidad estándar para ajustar los ponderados ecográficos en función de su edad gestacional y considerar las variaciones del peso durante el embarazo, de acuerdo con lo descrito por Gardosi 9). Finalmente, se calculó los Z-score (peso observado-peso esperado/desviación estándar) y se calcularon sus percentiles. La calculadora para realizar estas valoraciones se encuentra disponible en forma gratuita en la página web https://oswaldotipiani.com/
En la segunda etapa se validaron las curvas personalizadas. Se puso a prueba su capacidad de detección al estudiar una cohorte de neonatos en quienes se asumió que presentaron RCIU cuando el percentil de su peso al nacer fue menor de 3. Asimismo, se estudió la precisión diagnóstica de la condición de RCIU determinada por las curvas peruanas (variable independiente) para diagnosticar muerte perinatal (variable de salida). Estos resultados se compararon con los obtenidos por los estándares/tablas de referencia de la Organización Mundial de la Salud (OMS), Fundación de Medicina Fetal (FMF), Hadlock, Proyecto INTERGROWTH-21st (IG21) y del Instituto Nacional de Salud Infantil y Desarrollo Humano de los E.E. U.U. (NICHD, por sus siglas en inglés).
Posteriormente se realizó un estudio observacional de cohorte retrospectivo en el cual se revisó los registros obstétricos y neonatales de partos de entre 24 y 40 semanas atendidos en el Hospital Nacional Alberto Sabogal Sologuren (HNASS) del Seguro Social del Perú (EsSalud), en Lima-Perú, desde enero de 2018 hasta diciembre de 2022. Se estudió toda la población. Se excluyeron neonatos con anomalías congénitas según sus registros médicos, embarazos múltiples, datos incompletos de peso y talla maternos y datos atípicos (edad materna fuera de los 13 a 50 años, índice de masa corporal mayor de 46 o menor de 15 kg/cm2 y neonatos con peso > 5,500 g o < 500 g).
Para el análisis estadístico, al no existir a nivel mundial una curva que sea considerada como prueba de oro, se determinó la fiabilidad al estudiar la fuerza de concordancia entre el diagnóstico de RCIU (percentil de peso neonatal < 3) brindado por las curvas peruanas y el diagnóstico de RCIU dado por cada estándar/tabla internacional. Se usó el Kappa de Cohen (concordancia leve: 0,01 a 0,20; aceptable: 0,21 a 0,40; moderada: 0,41 a 0,60; buena o sustancial: 0,61 a 0,80 y casi perfecta: 0,81 a 1). Asimismo, se usó la prueba de McNemar para evaluar las discordancias entre curvas, con la hipótesis nula de que las discordancias se distribuyen de manera uniforme.
Por otro lado, se utilizaron tablas cruzadas de 2 x 2 tomando como variable independiente a la condición de RCIU dada por cada curva de crecimiento y a la muerte perinatal como variable de salida, definida esta como la presencia de muerte intrauterina (óbito) o de muerte neonatal dentro de los primeros 28 días de nacido. Se calculó la sensibilidad, la especificidad, el valor predictivo positivo (VPP), valor predictivo negativo (VPN), la exactitud (sensibilidad + especificidad/total), los falsos positivos y los likelihood ratio positivo (LR+) y negativo (LR-), con sus respectivos intervalos de confianza con el método de Wilson. Se usó SPSS versión 24 y R. La significancia estadística se fijó en 0,05. Se siguieron las recomendaciones de las directrices STARD para estudios sobre validez diagnóstica.
Con relación a los aspectos éticos, la investigación fue aprobada por el Comité de Ética del HNASS, el 22 de septiembre de 2022 (Código de registro 684-2022-598). El estudio se rigió por el reglamento de investigación clínica aplicada y las leyes de protección de datos personales vigentes en el Perú.
RESULTADOS
De 7,250 gestantes potencialmente elegibles, 6,598 cumplieron los criterios de selección. La figura 1 muestra el diagrama de flujo.
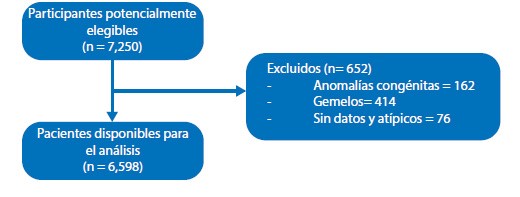
Figura 1 Diagrama de flujo de la selección de participantes
En la tabla 1 se muestran las características de la población estudiada. Se observó que el 33,8% de las pacientes tuvieron una edad materna avanzada y que la mayoría eran multíparas con un índice de masa corporal (IMC) normal. Solo el 6,5% presentó una talla baja. La incidencia de diabetes fue del 2,3%. Se halló porcentajes elevados de preeclampsia, prematuridad y de cesáreas. Hubo muerte perinatal en 129 casos (2%).
Tabla 1 Características demográficas materno-perinatales.

IMC: índice de masa corporal; DE: desviación estándar
En cuanto a las características de las curvas personalizadas, los pesos estimados para cada edad gestacional mostraron distribución normal (Kolmogorov-Smirnov o Shapiro-Wilk > 0,05), obteniendo un coeficiente de variación de 12,4 a las 40 semanas, el cual se fue incrementado conforme se reducía la edad gestacional hasta un valor de 18 a las 25 semanas.
Respecto de la fiabilidad de las curvas peruanas, considerando el valor mínimo del intervalo de confianza se encontró buena concordancia (sustancial) para el diagnóstico de RCIU entre las curvas peruanas e IG21 (valor mínimo del IC de Kappa = 0,62), concordancia moderada con Hadlock, NICHD y OMS (0,56 y 0,58 y 0,47, respectivamente) y concordancia aceptable solo con FMF (Kappa = 0,34). Asimismo, en el estudio de las discordancias se observó que el valor de p de McNemar fue > 0,05 cuando se comparó con IG21 (tabla 2).
Tabla 2 Concordancia entre las curvas personalizadas peruanas y otros estándares/tablas de crecimiento para el diagnóstico de RCIU.
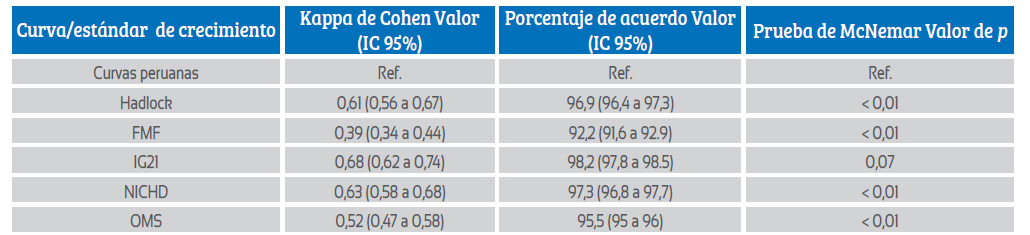
Ref.: referencia, FMF: Fundación de Medicina Fetal, IG21: Proyecto INTERGROWTH-21st, NICHD: Instituto Nacional de Salud Infantil y Desarrollo Humano de los EE. UU, OMS: Organización Mundial de la Salud.
En cuanto a su capacidad de detección, las curvas peruanas identificaron a 184 neonatos con RCIU (184/6,598 = 2,8%), porcentaje similar al 3,1% de IG21 (205/6,598) (p = 0,309), pero significativamente inferior al resto de curvas (Hadlock: 370/6,598; NICHD: 320/6,598 y OMS: 458/6,598). La tabla FMF fue significativamente superior al resto de curvas (694/6,598 = 10,5%) (p < 0,001) (figura 2).
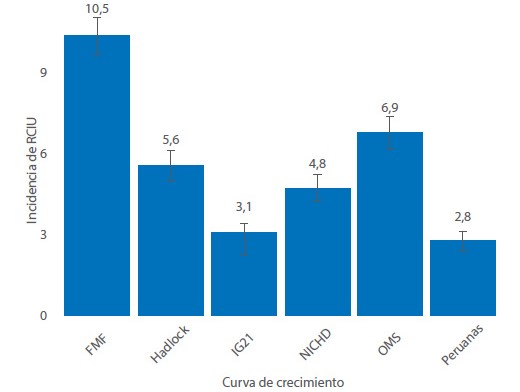
Figura 2 Incidencia de RCIU según curvas de crecimiento fetal
Respecto de sus medidas del efecto, el RR para muerte perinatal, dado por la condición de RCIU según las curvas personalizadas, fue de 7,2 (IC95% = 4,6 a 11,1), el cual se mantuvo significativo luego de ajustar para la prematuridad. En el análisis estratificado este riesgo mostró homogeneidad con Hadlock, IG21, NICHD y OMS (p = 0,592), obteniendo un RR combinado = 6,8 (IC95% = 5,7 a 8,1; p < 0,001). Al comparar este riesgo combinado con FMF la prueba de homogeneidad arrojó un chi-cuadrado = 8 (p = 0,004) (figura 3).
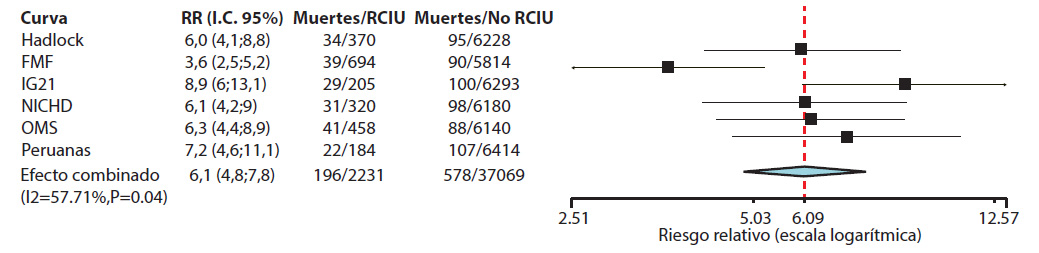
Figura 3 Riesgo relativo para muerte perinatal de la condición de RCIU según estándares/curvas de crecimiento.
En relación con medidas de precisión diagnóstica, la tabla 3 muestra que las diversas curvas de crecimiento tuvieron sensibilidades en un rango de 17% a 32%, con especificidades desde 90% hasta 97%. Asimismo, mostraron VPPs reducidos (6% a 14%) y VPNs elevados (98% a 99%). Los LR + tuvieron un rango desde 3 hasta 8,3, pero con elevados valores de LR- (0,7 a 0,8). Las curvas FMF mostraron los niveles más altos de falsos positivos (10%). La exactitud diagnóstica superó el 90% en la mayoría de las curvas.
Tabla 3 Medidas de precisión diagnóstica de la condición de RCIU según estándares/curvas de crecimiento para muerte perinatal.
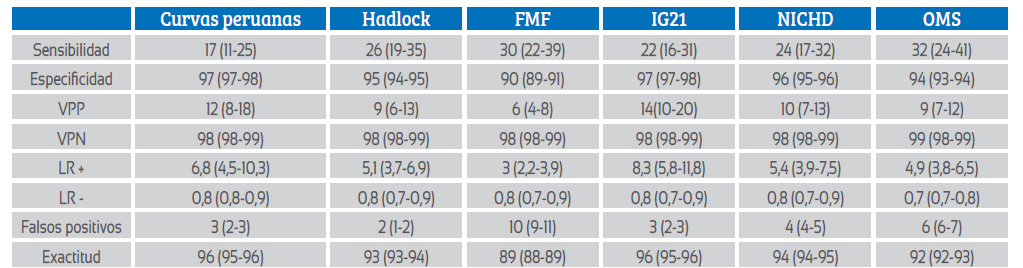
VPP: Valor predictivo positivo, VPN: Valor predictivo negativo, LR+: Likelihood ratio positivo, LR-: Likelihood ratio negativo, FMF: Fundación de Medicina Fetal, IG21: Proyecto INTERGROWTH-21st, NICHD: Instituto Nacional de Salud Infantil y Desarrollo Humano de los EE. UU, OMS: Organización Mundial de la Salud
DISCUSIÓN
Se encontró una buena concordancia entre las curvas personalizadas peruanas e IG21. Su rendimiento diagnóstico fue similar al resto de las curvas estudiadas. Sin embargo, al compararlas con FMF, las curvas personalizadas tuvieron menor tasa de falsos positivos, expresaron el riesgo de muerte perinatal con más fuerza que FMF, mostraron un LR que resultó el doble de lo conseguido por FMF y su exactitud diagnóstica fue también superior.
En cuanto a las características de las curvas personalizadas, se demostró el supuesto de normalidad de Gardosi 9 para los pesos estimados para cada edad gestacional. En cambio, sus coeficientes de variación fueron elevados en edades gestacionales muy tempranas, lo cual puede explicarse con el reducido número de muestra (menos de 30 casos a edades gestacionales menores de 28 semanas). Sin embargo, el CV de 12,4% obtenido a las 40 semanas (n = 1,086) es similar al 12% encontrado por Hocquette 16 para cada edad gestacional a término estudiada, aunque algo superior al obtenido por Gardosi (11%) 17).
Respecto de la fiabilidad, la concordancia para la condición de RCIU brindada por las curvas peruanas fue buena (sustancial) cuando se comparó con IG21. La prueba de McNemar tuvo un valor de p > 0,05, por lo que no se pudo rechazar la hipótesis nula de que las discordancias se distribuyen uniformemente debido al azar, a diferencia de la comparación con el resto de las curvas. Esto quiere decir que, si consideramos a IG21 como prueba de oro, estaríamos demostrando la fiabilidad de las curvas peruanas personalizadas. Por otro lado, especulamos que la baja concordancia con FMF podría deberse a la diferencia fenotípicas entre las poblaciones estudiadas, puesto que FMF incluyó en su diseño población inglesa, mayoritariamente blanca 4).
En relación con su capacidad de detección de neonatos que sufrieron de RCIU, se observó que su porcentaje (2,8%) fue muy similar a IG21 (3,1%), pero significativamente inferior al resto de estándares/tablas. Estos hallazgos coinciden con otros estudios, como el de Fernández 18 quien, usando IG21 en una muestra de 5,442 embarazos únicos, detectó 106/5,442 (2,0%, IC 95% 1,7 a 2,4%) de recién nacidos RCIU. Es más, en un estudio con gran población latinoamericana (n= 67,968), Miranda 19 encontró una prevalencia de RCIU de 2,1% bajo los criterios de IG21 y de 6,2% según OMS, resultados muy cercanos a los nuestros (3,1% y 6,9% para IG21 y OMS, respectivamente), existiendo la duda de si el estándar de la OMS detecta más las RCIU en América Latina o si las sobrediagnostica. Lo que sí parece estar claro es el sobrediagnóstico de RCIU cuando se usa FMF, pues su tasa de detección (10,5%) es significativamente superior a los otros estándares/tablas y cuya cifra es similar a la prevalencia a nivel mundial de pequeños para la edad gestacional (PEG) caracterizados por tener < percentil 10 20). Este hallazgo también fue observado por otro estudio, en el cual, al usar diversas curvas de crecimiento para detectar PEG, FMF halló una prevalencia del 24,4%, porcentaje muy superior al 6,8% de NICHD, 11,6% para OMS, 13,2% para IG21 y 16,2% para Hadlock 20).
En cuanto a la estimación del riesgo, hubo una superposición de los intervalos de confianza de los RR, por lo que todas las curvas expresaron significativamente mayor riesgo de muerte perinatal al detectar RCIU. Un metanálisis en el cual se comparó el riesgo de muerte perinatal al usar curvas personalizadas versus poblacionales encontró también una superposición de los intervalos de confianza de sus riesgos (OR = 5,8; IC95% = 3,8 a 7,8 y OR = 4; IC95% = 2,8 a 5,1 para curvas personalizadas y poblacionales, respectivamente) 21). Cabe destacar nuevamente que FMF fue la curva cuyo RR fue significativamente inferior al de las demás curvas, las cuales mostraron homogeneidad entre ellas. Estos hallazgos son similares a los de Kabiri y col. 20 quienes, al estudiar resultados perinatales adversos en fetos PEG, obtuvieron altos puntajes de RR con NICHD (2,46; IC95% = 1,9 a 3,1) pero bajos con FMF(1,47; IC95% = 1,2 a 1,8).
En cuanto a las medidas de precisión diagnóstica de las curvas peruanas, estas fueron muy similares al resto de estándares/tablas, mostrando buenos valores de exactitud diagnóstica, bajas sensibilidades y VVPs, pero elevadas especificidades y VPNs, lo cual muestra la utilidad de las curvas de crecimiento como herramientas que comunican tranquilidad al médico y a la paciente cuando el peso de un feto se encuentra sobre el percentil 3, pues la probabilidad de muerte perinatal es muy baja. Sin embargo, ninguna de las curvas podría ser usada como prueba de tamizaje, pues las sensibilidades y VPPs son pobres. Estos hallazgos son compatibles con los encontrados por Grantz 22 cuando, al estudiar la morbilidad neonatal en fetos PEG usando 3 modelos de curvas personalizadas, encontró sensibilidades y especificidades de 13 a 15% y de 89 a 93%, respectivamente, así como VPPs y NPNs de 5,6 a 7,2% y 96,3%, respectivamente. Asimismo, Kabiri, al estudiar fetos PEG en relación con muerte perinatal, halló sensibilidades desde 25% a 40% y especificidades desde 84% hasta 93%; así como VVPs desde 1 hasta 2 % y VPN de 100% (20). Por otro lado, las curvas peruanas indicaron que es 6,8 veces más probable que un resultado de RCIU provenga de un feto que sufrirá muerte perinatal que de uno que no lo hará (LR+), mostrando una fuerte evidencia para confirmar el diagnóstico. Sin embargo, los LR- no respaldaron estos puntajes, pues no alcanzaron el valor ideal para ninguna curva de crecimiento (LR- ideal: < 0,2). Estos hallazgos son similares a los descritos por Melamed y col. 10), quien observó que entre fetos PEG los LR+ eran significativamente superiores para detectar alteraciones placentarias con el uso de curvas personalizadas (LR+ = 3,4) en lugar de estándares poblacionales, pero, también sin alcanzar LR- ideales (LR- = 0,8)
También es de notar que las curvas peruanas mostraron una de las tasas más bajas de falsos positivos (3%) en comparación con OMS (6%) y FMF (10%). Estos hallazgos podrían aclarar las diferencias en las tasas de detección entre estas curvas y la interpretación de las mismas: las curvas de la OMS y FMF muestran mayor tasa de detección de RCIU que las personalizadas, pero con falsos positivos más altos. Esto explicaría, también, lo hallado en el estudio de Miranda 19 de que, aparentemente, OMS detectaba más neonatos PEG que usando IG21, pero con mayor rendimiento diagnóstico de IG21 para puntaje de Apgar e índice ponderal bajos. Debemos recordar que los falsos positivos pueden llevar a intervenciones innecesarias y ansiedad para los pacientes 20).
Basados en estos resultados podemos afirmar que las curvas personalizadas peruanas son fiables en su evaluación de la RCIU. Que sus medidas de detección y de precisión diagnóstica fueron similares a IG21, estándar que mostró uno de los mejores rendimientos diagnósticos al evaluar un considerable número de neonatos de la población peruana. Que su rendimiento fue algo superior a FMF y que, debido a su elevado valor predictivo negativo, es una tabla que brinda tranquilidad cuando sus percentiles descartan la RCIU.
La principal fortaleza del estudio es su tamaño de muestra, el cual nos permite evaluar la mortalidad perinatal con un poder estadístico adecuado. Otra fortaleza es la comparación de las curvas peruanas con cinco de los estándares/tablas más usadas en el mundo, lo cual nos permite conocer también sus resultados en la evaluación de neonatos en la población peruana. Sin embargo, también presenta debilidades, como el usar curvas de crecimiento intrauterino para evaluar pesos neonatales. Sin embargo, dado que el resultado de interés (muerte perinatal) es una variable posnatal, la exposición de interés fue el peso < percentil 3 al momento del nacimiento, siendo este un indicador aceptable 10). Asimismo, debido a que todas las curvas fueron estudiadas bajo las mismas condiciones, los hallazgos comparativos son válidos para estudiar concordancias y diferencias entre ellas 19). Por otro lado, definimos RCIU basados únicamente en el peso fetal, sin incluir la circunferencia abdominal, que también está aceptada y recomendada para este fin 1). Asimismo, este estudio se realizó en un centro de nivel terciario que concentra casos de alta morbilidad materna y perinatal, por lo que los resultados deberán validarse también en centros sanitarios de bajo riesgo.
CONCLUSIÓN
Las curvas peruanas personalizadas resultaron fiables en su evaluación de la RCIU. Su capacidad de detección y su precisión diagnóstica fueron similares a otros estándares/tablas internacionales, pero algo superiores a la FMF.
Agradecimientos
Agradecemos a Juan Carlos Lescano por su ayuda en la recolección de datos y al personal médico y residentes del Departamento de Ginecobstetricia del HNASS.
REFERENCIAS
1. Lees CC, Stampalija T, Baschat A, da Silva Costa F, Ferrazzi E, Figueras F, et al. ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol. August 2020;56(2):298-312. doi: 10.1002/uog.22134 [ Links ]
2. Visser GHA, Nicholson WK, Barnea ER, Ramasauskaite D, Nassar AH, FIGO Safe Motherhood, Newborn Health Committee. FIGO position paper on reference charts for fetal growth and size at birth: Which one to use? Int J Gynaecol Obstet. February 2021;152(2):148-51. doi: 10.1002/ijgo.13500 [ Links ]
3. Hadlock FP, Harrist RB, Carpenter RJ, Deter RL, Park SK. Sonographic estimation of fetal weight. The value of femur length in addition to head and abdomen measurements. Radiology [Internet]. February 1984 [cited 10 December 2022];150(2):535- 40. https://pubs.rsna.org/doi/10.1148/radiology.150.2.6691115 [ Links ]
4. Nicolaides KH, Wright D, Syngelaki A, Wright A, Akolekar R. Fetal Medicine Foundation fetal and neonatal population weight charts. Ultrasound Obstet Gynecol. July 2018;52(1):44-51. doi: 10.1002/uog.19073 [ Links ]
5. Kiserud T, Piaggio G, Carroli G, Widmer M, Carvalho J, Neerup Jensen L, et al. The World Health Organization Fetal Growth Charts: A Multinational Longitudinal Study of Ultrasound Biometric Measurements and Estimated Fetal Weight. PLoS Med. January 2017;14(1):e1002220. doi: 10.1371/journal. pmed.1002220 [ Links ]
6. Odibo AO, Nwabuobi C, Odibo L, Leavitt K, Obican S, Tuuli MG. Customized fetal growth standard compared with the INTERGROWTH-21st century standard at predicting small-for-gestational-age neonates. Acta Obstet Gynecol Scand. November 2018;97(11):1381-7. doi: 10.1111/aogs.13394 [ Links ]
7. Buck Louis GM, Grewal J, Albert PS, Sciscione A, Wing DA, Grobman WA, et al. Racial/Ethnic Standards for Fetal Growth, the NICHD Fetal Growth Studies. Am J Obstet Gynecol [Internet]. October 2015 [cited 11 November 2022];213(4):449.e1-449. e41. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4584427/ [ Links ]
8. Hugh O, Williams M, Turner S, Gardosi J. Reduction of stillbirths in England from 2008 to 2017 according to uptake of the Growth Assessment Protocol: 10-year population-based cohort study. Ultrasound Obstet Gynecol. March 2021;57(3):401-8. doi: 10.1002/uog.22187 [ Links ]
9. Gardosi J, Francis A, Turner S, Williams M. Customized growth charts: rationale, validation and clinical benefits. Am J Obstet Gynecol. February 2018;218(2S):S609-18. doi: 10.1016/j.ajog.2017.12.011 [ Links ]
10. Melamed N, Hiersch L, Aviram A, Keating S, Kingdom JC. Customized birth-weight centiles and placenta-related fetal growth restriction. Ultrasound Obstet Gynecol. March 2021;57(3):409- 16. doi: 10.1002/uog.23516 [ Links ]
11. Papageorghiou AT, Kennedy SH, Salomon LJ, Altman DG, Ohuma EO, Stones W, et al. The INTERGROWTH-21st fetal growth standards: toward the global integration of pregnancy and pediatric care. Am J Obstet Gynecol. February 2018;218(2S):S630- 40. doi: 10.1016/j.ajog.2018.01.011 [ Links ]
12. Iliodromiti S, Smith GCS, Lawlor DA, Pell JP, Nelson SM. UK stillbirth trends in over 11 million births provide no evidence to support effectiveness of Growth Assessment Protocol program. Ultrasound in Obstetrics & Gynecology [Internet]. 2020 [cited 15 December 2022];55(5):599-604. https://onlinelibrary.wiley.com/doi/abs/10.1002/uog.21999 [ Links ]
13. Kajdy A, Filipecka-Tyczka D, Muzyka-Placzynska K, Modzelewski J, Sys D, Baranowska B, et al. Fetal Growth Diagnosis and Management among Perinatal Medical Professionals: A Survey of Practice and Literature Review. Fetal Diagn Ther. 2021;48(5):342-52. doi: 10.1159/000514504. [ Links ]
14. Ticona-Rendón M, Huanco-Apaza D. Curva de referencia peruana del peso de nacimiento para la edad gestacional y su aplicación para la identificación de una nueva población neonatal de alto riesgo. Rev peru med experim salud publica [Internet]. October 2007 [cited 7 December 2023];24(4):325-35. http://www.scielo.org.pe/scielo.php?script=sci_abstract&pid=S1726-46342007000400002&lng=es&nrm=iso&tlng=es [ Links ]
15. Tipiani O, Malaverry H, Páucar M, Romero E, Broncano J, Aquino R, et al. Curva de crecimiento intrauterino y su aplicación en el diagnóstico de restricción del crecimiento intrauterino. Rev peru ginecol Obstet [Internet]. 2011 [cited 25 October 2022];57(2):69-76. http://51.222.106.123/index.php/RPGO/article/view/188 [ Links ]
16. Hocquette A, Monier I, Blondel B, Dufourg MN, Heude B, Zeitlin J. Testing the assumptions of customized intrauterine growth charts using national birth studies. Acta Obstet Gynecol Scand. April 2022;101(4):405-16. doi: 10.1111/aogs.14335 [ Links ]
17. Gardosi J, Mongelli M, Wilcox M, Chang A. An adjustable fetal weight standard. Ultrasound Obstet Gynecol [Internet]. 1995 [cited 23 September 2023];6(3):168-74. https://onlinelibrary.wiley.com/doi/abs/10.1046/j.1469-0705.1995.06030168.x [ Links ]
18. Fernandez-Rodriguez B, Alba C de, Galindo A, Recio D, Villalain C, Pallas CR, et al. Obstetric and pediatric growth charts for the detection of late-onset fetal growth restriction and neonatal adverse outcomes. J Perinat Med [Internet]. 1 February 2021 [cited 25 September 2023];49(2):216-24. https://www.degruyter.com/document/doi/10.1515/jpm-2020-0210/html [ Links ]
19. Miranda J, Maestre N, Paternina-Caicedo Á, Parra-Saavedra M, Caradeux J, Sepulveda-Martinez Á, et al. Performance of the INTERGROWTH-21st and World Health Organization fetal growth charts for the detection of small-for-gestational age neonates in Latin America. Intern J Gynecol Obstet [Internet]. 2023 [cited 23 September 2023];161(3):1083-91. https://onlinelibrary.wiley.com/doi/abs/10.1002/ijgo.14657 [ Links ]
20. Kabiri D, Romero R, Gudicha DW, Hernandez-Andrade E, Pacora P, Benshalom-Tirosh N, et al. Prediction of adverse perinatal outcome by fetal biometry: comparison of customized and population-based standards. Ultrasound Obstet Gynecol [Internet]. 2020 [cited 11 November 2022];55(2):177-88. https://onlinelibrary.wiley.com/doi/abs/10.1002/uog.20299 [ Links ]
21. Chiossi G, Pedroza C, Costantine MM, Truong VTT, Gargano G, Saade GR. Customized vs population-based growth charts to identify neonates at risk of adverse outcome: systematic review and Bayesian meta-analysis of observational studies. Ultrasound Obstet Gynecol [Internet]. 2017 [cited 27 September 2023];50(2):156-66. https://onlinelibrary.wiley.com/doi/abs/10.1002/uog.17381 [ Links ]
22. Grantz KL, Hediger ML, Liu D, Buck Louis GM. Fetal growth standards: the NICHD fetal growth study approach in context with INTERGROWTH-21st and the World Health Organization Multicentre Growth Reference Study. Am J Obstet Gynecol. February 2018;218(2S):S641-S655.e28. doi: 10.1016/j.ajog.2017.11.593 [ Links ]
留言 (0)