ORIGINAL PAPERS / ARTICLES ORIGINAUX
DERIVATION VENTRICULAIRE EXTERNE DANS LA PRISE EN CHARGE DE L’HYDROCEPHALIE AIGÜE : Expérience du service de neurochirurgie de l’Hôpital Principal de Dakar
EXTERNAL VENTRICULAR SHUNT IN THE MANAGEMENT OF ACUTE HYDROCEPHALY: experience of the neurosurgery department of “Hôpital Principal de Dakar”
RESUME
Introduction
L’hydrocéphalie aigüe est une urgence diagnostique et thérapeutique. Le but de notre travail était d’analyser les indications et les résultats de la dérivation ventriculaire externe (DVE) dans la prise en charge de l’hydrocéphalie aigüe dans des conditions de pratique aux ressources limitées.
Patients et méthode
Il s’agit d’une étude rétrospective allant de Janvier 2019 à Juin 2022 concernant une série de 27 cas d’hydrocéphalie aigüe. Tous les patients étaient pris en charge pour la pose d’une DVE par les neurochirurgiens de l’Hôpital Principal de Dakar.
Résultats
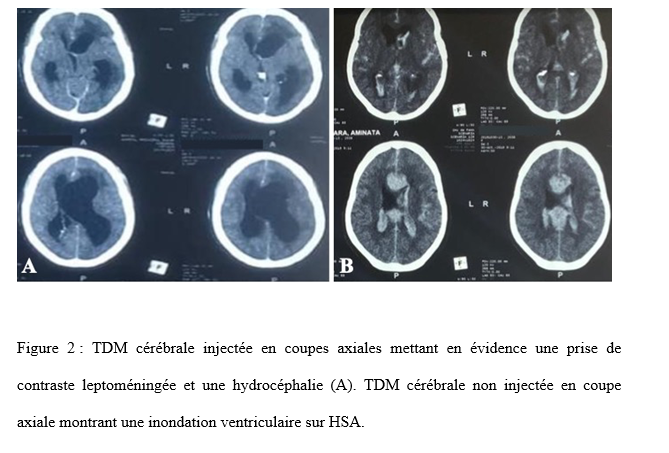
Une prédominance masculine était notée avec un sex-ratio de 2 et l’âge moyen était de 43,78 ans. Nos patients présentaient un tableau d’HTIC grave avec troubles de la conscience et un score de Glasgow moyen de 9, avec des extrêmes allant de 03 à 14. Douze (44,44%) avaient un Glasgow inférieur ou égal à 8. La tomodensitométrie (TDM) cérébrale objectivait une hydrocéphalie aigüe post-hémorragie cérébrale avec inondation ventriculaire dans 15 cas (55,6%), à savoir une hémorragie sous arachnoïdienne (HSA) dans 08 cas ; et un hématome intra cérébral spontané chez 07 patients. Des signes de méningo-encéphalite sous forme de prise de contraste leptoméningée étaient retrouvés chez 07 patients (25,9%) ; une décompensation d’une hydrocéphalie sur tumeur de la fosse cérébrale postérieure chez 03 patients (11,1%) ; une hémorragie intraventriculaire au décours d’une chirurgie hypophysaire et d’un traumatisme crânio-encéphalique (TCE) grave respectivement dans 01 cas chacun (3,7%). Une DVE était donc réalisée au bloc opératoire, en urgence le même jour dans 17 cas, et dans un délai de 48 heures chez 10 patients. La DVE était maintenue en place chez nos patients en moyenne 6,3 jours. La DVE était retirée dans 10 cas devant l’amélioration de l’état neurologique. Nous avions une mortalité de 70,4% dans un délai de 6 jours en moyenne, avec des extrêmes allant de 03 à 12 jours après la pose de la DVE chez 19 patients.
Conclusion
Malgré les complications, la dérivation ventriculaire externe reste une méthode de choix dans la prise en charge de l’hydrocéphalie aigüe dans notre pratique. La maitrise de la technique et la rapidité dans la prise en charge sont nécessaires pour améliorer le pronostic des patients.
Mots clés
Dérivation ventriculaire externe, Hydrocéphalie aigue, Hôpital Principal de Dakar.
ABSTRACT
Introduction
Acute hydrocephalus is a diagnostic and therapeutic emergency. The aim of our work was to analyze the indications and outcomes of external ventricular shunt (EVD) in the management of acute hydrocephalus in resource-limited practice conditions.
Patients and method
This is a retrospective study from January 2019 to June 2022 concerning a series of 27 cases of acute hydrocephalus. All the patients were treated for EVD in the neurosurgery department of “Hôpital Principal de Dakar”.
Results
We note a male predominance with a sex ratio of 2 and the average age was 43.78 years. Our patients were received with an average Glasgow score of 9, and extremes ranging from 03 to 14. Twelve (44.44%) of them had a Glasgow less than or equal to 8. Cerebral computed tomography (CT scan) showed acute hydrocephalus due to a cerebral hemorrhage with ventricular flooding in 15 cases (55.6%); namely subarachnoid hemorrhage in 08 cases and hemorrhagic stroke in 07 patients. Signs of meningoencephalitis were found in 07 patients (25.9%); decompensation of tumoral hydrocephalus in 03 patients (11.1%); intraventricular hemorrhage following brain surgery and severe traumatic brain injury respectively in 01 case each (3.7%). An EVD was performed in the operating room, urgently on the same day in 17 cases, and within 48 hours in 10 patients. The duration of the EVD was on average 6.3 days. EVD was removed in 10 cases due to improvement in neurological signs. We had a total mortality of 70.4% within 6 days on average, with extremes ranging from 03 to 12 days after EVD placement in 19 cases.
Conclusion
Despite the complications, external ventricular shunt remains a method of choice in the management of acute hydrocephalus in our practice. Mastery of the technique and speed in treatment are necessary to improve patient prognosis.
Key words
External ventricular shunt (EVD), Acute hydrocephalus, Hôpital Principal de Dakar.
INTRODUCTION
L’hydrocéphalie se définit comme une dilatation active du système ventriculaire cérébral, soumis à un régime de pression anormalement élevée (1). L’hydrocéphalie aigue est une urgence médicale, elle peut se présenter sur un mode brutal d’emblée ou par décompensation d’une hydrocéphalie subaigüe ou chronique. Le traitement de référence pour l’hydrocéphalie aigue est l’insertion d’une dérivation ventriculaire externe (DVE) qui est une procédure d’urgence visant à drainer de façon externe et temporaire, le liquide cérébro-spinal (LCS) afin de réduire la pression intracrânienne (PIC) (2). Nous avons ainsi mené une étude rétrospective concernant 27 observations de patients présentant une hydrocéphalie aigüe chez qui les indications et les résultats de la DVE ont été évalués dans nos conditions de pratique.
PATIENTS ET METHODE
Il s’agit d’une étude rétrospective à visée analytique portant sur une période allant de Janvier 2019 à Juin 2022 soit une durée de 42 mois. Nous avons inclus les patients qui présentaient un tableau clinique d’hypertension intracrânienne et chez qui le scanner cérébral objectivait une hydrocéphalie aigüe. Une indication de DVE en urgence était posée et réalisée. Nous avons exclu de notre étude les patients dont les dossiers étaient incomplets ou non retrouvés. Les paramètres étudiés étaient les données épidémiologiques, cliniques, paracliniques, le délai de la chirurgie, et l’évolution de nos patients.
RESULTATS
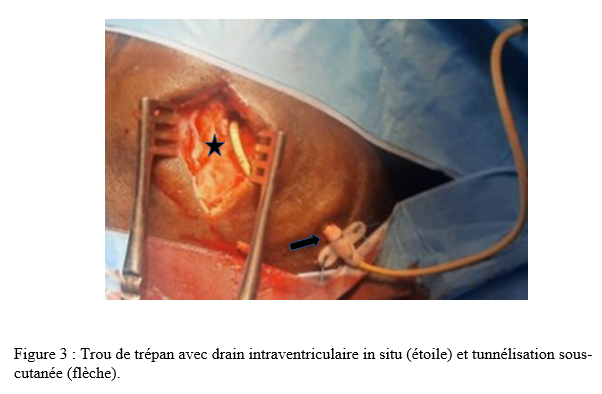
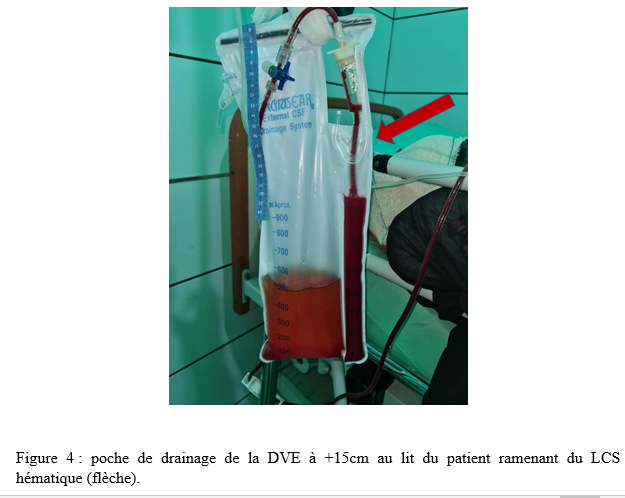
Nous avions retenu 27 dossiers avec une moyenne d’âge de 43,78 ans, et des extrêmes allant de 12 à 76 ans. Notre étude comportait 9 patients de sexe féminin soit 33,33% et 18 patients de sexe masculin soit 66,67%, avec un sex-ratio de 2. Au sein de notre série 12 patients (44,44%) présentaient une hypertension artérielle dont 10 cas parmi ceux ayant présenté une hémorragie cérébrale. Nos patients avaient été reçus avec un score de Glasgow moyen de 9. Les extrêmes allaient de 03 à 14. Douze (44,44%) avaient un Glasgow inférieur ou égal à 8, chez qui une sédation plus intubation orotrachéale (IOT) était réalisée. L’examen des pupilles retrouvait une mydriase bilatérale réactive chez 06 de nos patients et une anisocorie dans 05 cas. Un scanner cérébral était réalisé chez tous nos patients (figure 1), mettant en évidence une hydrocéphalie aigue suite à une hémorragie sous arachnoïdienne (HSA) avec inondation intraventriculaire grade 4 de Fisher modifié (figure 2) dans 08 cas. Un hématome intra cérébral spontané avec inondation intraventriculaire massive et des signes de méningo-encéphalite sous forme de prise de contraste leptoméningée (figure 2) étaient retrouvés respectivement chez 07 patients chacun. Une hydrocéphalie obstructive sur tumeur de la fosse cérébrale postérieure était objectivée chez 03 patients ; une hémorragie massive intraventriculaire post chirurgie hypophysaire et une hémorragie intraventriculaire post traumatique dans un cas chacun. Une DVE était donc réalisée en urgence au bloc opératoire chez tous nos patients. Un cathétérisme de la corne frontale du ventricule latéral était réalisé par abord classique au point de Kocher, puis une tunnélisation sous cutanée du drain était effectuée (figure 3). Un kit de DVE de la marque CHHABRA avait été utilisé chez tous nos patients. La poche de drainage de la DVE était positionnée au lit du malade à +15 cm par rapport à la ligne horizontale passant par le conduit auditif externe chez tous nos patients. La DVE était productive et le LCS était hématique (figure 4) dans 15 cas, clair chez 11 patients et trouble dans 01 cas. A J1 post-DVE, nous avions des quantités de LCS allant de 57 ml à 400 ml avec un drainage moyen de 181 ml par 24H. A court terme, 14 patients avaient évolué favorablement avec un score de Glasgow amélioré dans les 48 heures post-DVE. Le reste des patients avait une évolution stationnaire ou défavorable. Une TDM cérébrale de contrôle immédiate n’avait été réalisée que chez un patient, objectivant un drain de DVE en place en intraventriculaire avec une régression de l’hydrocéphalie. La DVE était maintenue en place chez nos patients en moyenne 6,3 jours avec des extrêmes allant de 03 à 13 jours. La DVE était retirée dans 10 cas devant l’amélioration de l’état neurologique avec un score de Glasgow allant de 11 à 15. Notons que 02 de ces patients étaient décédés dans les suites de l’ablation de la DVE dans un contexte d’aggravation secondaire. Nous avions au total une mortalité de 70,4% dans un délai de 6 jours en moyenne, avec des extrêmes allant de 03 à 12 jours après la pose de la DVE chez 19 patients. Le contexte du décès était un resaignement et/ou un engagement cérébral suspecté dans 09 cas (47,3%), et un choc septique sur BMR (Bactéries Multi Résistantes) dans 08 cas (42,1%). Un patient était décédé des suites de son traumatisme, et un autre des suites d’exérèse d’une tumeur hypophysaire.
DISCUSSION
Dans l’hydrocéphalie aigüe, le tableau clinique est dominé par l’aggravation du syndrome d’HTIC ou l’installation de signes de gravité, sans être spécifiques. Des antécédents d’hypertension artérielle sont significativement liés à la survenue d’hydrocéphalie aigüe (3, 4), pouvant s’expliquer par le fait que l’HTA non contrôlée est le facteur de risque le plus courant d’hémorragie intracrânienne spontanée (5, 6, 7). Ainsi, les présentations cliniques de nos patients restent globalement similaires et se rapprochent des données de la littérature (8, 9). Le scanner cérébral reste l’examen le plus accessible dans nos conditions d’exercice, donc de première intention, pour le diagnostic de l’hydrocéphalie aigue (10). L’effet de l’hémorragie intraventriculaire sur le développement de l’hydrocéphalie a été bien établi dans la littérature (3, 4, 11, 12). L’imagerie par résonance magnétique (IRM) cérébrale intervient dans la recherche étiologique et le retentissement parenchymateux de l’hydrocéphalie. Aucune IRM cérébrale n’avait été réalisée chez nos patients, pouvant s’expliquer dans notre contexte non seulement par le caractère urgent de l’hydrocéphalie aigüe mais aussi par l’inaccessibilité de l’IRM de par son coût et son indisponibilité dans certaines structures. La dérivation ventriculaire externe est le traitement d’urgence de l’hydrocéphalie aigüe. Elle présente en outre l’intérêt de permettre une mesure continue de la pression intracrânienne. La mesure de la PIC n’était réalisée chez aucun de nos patients car étant indisponible dans nos ressources. Il est à noter que dans notre contexte, au Sénégal, les kits de dérivation ventriculaire sont de la marque CHHABRA. Une ventriculostomie endoscopique (VCE) peut être réalisée en préopératoire ou peropératoire pour traiter au préalable l’hydrocéphalie chez des patients présentant une tumeur de la FCP avec hydrocéphalie sus jacente (13). La VCE apparaît comme un traitement de choix des hydrocéphalies aigües tri-ventriculaires obstructives (14). Cette technique n’avait pas été réalisée chez nos patients car ils présentaient des troubles de la conscience par décompensation d’une hydrocéphalie tumorale. Par ailleurs, la DVE était posée en urgence chez ces patients dès l’admission puis l’exérèse tumorale était secondairement réalisée. La DVE était faite au bloc opératoire avec une asepsie rigoureuse et une tunnélisation sous-cutanée réalisée chez tous nos patients. En raison de complications occasionnelles associées à la mise en place de la DVE au chevet du patient, certains ont recommandé le placement de la DVE en salle d’opération. Cette recommandation permet d’obtenir une technique plus stérile, une meilleure visualisation et une hémostase plus optimale du trou de trépan, et de procéder à la tunnélisation du drain (15). Cependant, la nature aigüe de l’augmentation de la PIC, le temps supplémentaire nécessaire pour accéder à la salle d’opération, les difficultés liées au transport des patients ont continué de favoriser l’utilisation émergente de la technique au chevet du patient (16). Concernant les HSA, la problématique du risque de resaignement lié au drainage ventriculaire reste une polémique, même si de nombreux auteurs ne trouvent pas de corrélation nette (9). Parmi nos patients, nous avons suspecté des cas de resaignement. La DVE était productive chez tous nos patients. La DVE était maintenue en place chez nos patients en moyenne 6,3 jours, avec des extrêmes allant de de 03 à 13 jours. Elle ne doit être laissée en place que pendant une courte période, en raison du risque septique. Ce délai varie entre 5 à 15 jours (17, 18, 19). La problématique du risque de survenue d’infection sur des DVE posées très longtemps soulève encore la controverse mais aucune série ne montre une corrélation positive entre la durée de la DVE et le taux de ventriculite (20, 21). La DVE était retirée dans 10 cas devant l’amélioration de l’état neurologique avec un score de Glasgow allant de 11 à 15. Chez ces derniers, une réduction significative du drainage était notée autorisant l’augmentation de la contre pression suivie d’un clampage du drain sur 48 heures avant son ablation. Notons que 02 de ces patients étaient décédés dans les suites de l’ablation de la DVE dans un contexte d’aggravation secondaire. Nous avions au total une mortalité de 70,4% dans un délai de 6 jours en moyenne, après la pose de la DVE chez 19 patients. Le contexte du décès était un resaignement et/ou un engagement cérébral suspecté devant une aggravation neurologique dans 09 cas (47,3%), et un choc septique sur BMR (Bactéries Multi Résistantes) dans 08 cas (42,1%) dont 03 dans un contexte de pneumopathie. Le taux d’infection sur DVE varie de 5 à 50% dans la littérature (22). Notons également que le taux de mortalité élevé de notre série n’est pas directement lié à la technique chirurgicale. Cette mortalité pourrait être expliquée par l’évolution propre de la pathologie causale, mais aussi par certaines défaillances du système sanitaire. Il faut noter l’absence de la mesure de PIC et d’une unité de neuroréanimation spécialisée dans notre pratique quotidienne. Tout ceci participant ainsi à assombrir d’avantage le pronostic de nos patients.
CONCLUSION
L’hydrocéphalie aigüe constitue un important facteur de mauvais pronostic et de surmortalité dans notre pratique. La dérivation ventriculaire externe, même si elle est associée à des complications graves telles que les infections, reste une méthode de choix dans la prise en charge en urgence. Cependant, la maitrise de la technique et la rapidité dans la prise en charge sont nécessaires pour de bons résultats.

REFERENCES
CHAUVET D, BOCH A-L. Hydrocéphalie. EMC – Traité de médecine AKOS. 2011;6(2):1-8. MURALIDHARAN R. External ventricular drains: Management and complications. Surg Neurol Int. 2015 May 25;6(Suppl6):S271-4. GRAFF-RADFORD NR. Factors Associated With Hydrocephalus After Subarachnoid Hemorrhage: A Report of the Cooperative Aneurysm Study. Arch Neurol 1989;46(7):744. MEHTA V, HOLNESS RO, CONNOLLY K, WALLING S, HALL R. Acute Hydrocephalus Following Aneurysmal Subarachnoid Hemorrhage. Can j neurol sci 1996;23(1):40-45. ARIESEN MJ, CLAUS SP, RINKEL GJE, ALGRA A. Risk Factors for Intracerebral Hemorrhage in the General Population: A Systematic Review. Stroke 2003;34(8):2060-2065. MCCORMICK WF, ROSENFIELD DB. Massive Brain Hemorrhage: A Review of 144 Cases and an Examination of Their Causes. Stroke 1973;4(6):946-954. MERETOJA A, STRBIAN D, PUTAALA J, CURTZE S, HAAPANIEMI E, MUSTANOJA S, ET AL. SMASH-U: A Proposal for Etiologic Classification of Intracerebral Hemorrhage. Stroke 2012;43(10):2592-2597. DEHDASHTI AR, RILLIET B, RUFENACHT DA, DE TRIBOLET N. Shunt-dependent hydrocephalus after rupture of intracranial aneurysms: a prospective study of the influence of treatment modality. Journal of Neurosurgery 2004;101(3):402-407. HELLINGMAN CA, VAN DEN BERGH WM, BEIJER IS, VAN DIJK GW, ALGRA A, VAN GIJN J, ET AL. Risk of Rebleeding After Treatment of Acute Hydrocephalus in Patients With Aneurysmal Subarachnoid Hemorrhage. Stroke 2007;38(1):96-99. CHEN S, LUO J, REIS C, MANAENKO A, ZHANG J. Hydrocephalus after Subarachnoid Hemorrhage: Pathophysiology, Diagnosis, and Treatment. BioMed Research International 2017;2017:1-8. TODO T, USUI M, TAKAKURA K. Treatment of severe intraventricular hemorrhage by intraventricular infusion of urokinase. Journal of Neurosurgery 1991;74(1):81-86. VALE FL, BRADLEY EL, FISHER WS. The relationship of subarachnoid hemorrhage and the need for postoperative shunting. Journal of Neurosurgery 1997;86(3):462-466. KOLEVA M, DE JESUS O. Hydrocephalus. 2023 Feb 12. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 32809710. M. LEFRANC, J. PELTIER, A. FICTHTEN, C. DESENCLOS, P. TOUSSAINT, D. LE GARS. Place de la ventriculocisternostomie endoscopique en urgence dans le traitement des hydrocéphalies aiguës obstructives tri- ventriculaires. Neurochirurgie 53(2007)450–457. Z. ROITBERG, N. KHAN, M. S. ALP, T. B. Bedside external ventricular drain placement for the treatment of acute hydrocephalus. British Journal of Neurosurgery 2001;15(4):324-327. DEY M, JAFFE J, STADNIK A, AWAD IA. External Ventricular Drainage for Intraventricular Hemorrhage. Current Neurology and Neuroscience Reports 2012;12(1):24-33. ALOSTERY N, DÉMARET C, GORNY M, LAMOUR V, VEGA E, BARONCINI M. Gestion paramédicale de la dérivation ventriculaire externe en réanimation neurochirurgicale. Méd Intensive Réa 2016;25,649–654. RAO SS, CHUNG DY, WOLCOTT Z, SHERIFF F, KHAWAJA AM, LEE H, ET AL. Intermittent CSF drainage and rapid EVD weaning approach after subarachnoid hemorrhage: association with fewer VP shunts and shorter length of stay. Journal of Neurosurgery 2020;132(5):1583-1588. WOODWARD S, ADDISON C, SHAH S, BRENNAN F, MACLEOD A, CLEMENTS M. Benchmarking best practice for external ventricular drainage. British Journal of Nursing 2002;11(1):47-53. HOEFNAGEL D, DAMMERS R, TER LAAK-POORT MP, AVEZAAT CJJ. Risk factors for infections related to external ventricular drainage. Acta Neurochir (Wien) 2008;150(3):209-214. SCHEITHAUER S, BÜRGEL U, BICKENBACH J, HÄFNER H, HAASE G, WAITSCHIES B, ET AL. External ventricular and lumbar drainage-associated meningoventriculitis: prospective analysis of time-dependent infection rates and risk factor analysis. Infection 2010;38(3):205-209. LANKIANG JEANNIE DEMILTA. La derivation ventriculaire externe apres hemorragie cerebro-meningee : indications, resutats. Méd No127. Dakar: Université CHEIKH ANTA DIOP, 2015.
留言 (0)