L’amyloïdose à transthyrétine se manifeste généralement sous forme de neuropathie de compression, de polyneuropathie ou d’insuffisance cardiaque; certaines personnes peuvent présenter une dysautonomie ou des symptômes d’une atteinte du système nerveux central.
Bien que des signes de l’amyloïdose à transthyrétine (p. ex., syndrome du canal carpien bilatéral, neuropathies autonomes et dépendantes de la longueur des fibres, insuffisance cardiaque, fibrillation auriculaire) soient fréquents chez les personnes qui n’en sont pas atteintes, on doit soupçonner fortement cette affection chez la patientèle qui présente plus d’une caractéristique classique, particulièrement lorsque ces caractéristiques sont réfractaires au traitement, de même qu’en présence d’antécédents familiaux.
Le diagnostic de l’amyloïdose à transthyrétine est posé par une coloration au rouge Congo des biopsies de tissus ou par dépistage génétique.
L’inotersen et le tafamidis sont de nouveaux traitements qui peuvent ralentir la progression des manifestations cardiaques et neurologiques et améliorer la qualité de vie.
Nous avons hospitalisé en médecine interne générale un homme droitier de 65 ans qui présentait une insuffisance cardiaque décompensée et des saignements gastro-intestinaux. Il avait d’abord consulté son médecin de famille 7 ans auparavant pour un engourdissement et une paresthésie nocturnes intermittents aux 3 premiers doigts de la main droite, qui se sont aggravés progressivement pour s’étendre plus tard à la main gauche. Il avait alors reçu un diagnostic clinique de syndrome du canal carpien bilatéral et avait été traité, sans succès, avec des attelles pour les poignets. Deux ans plus tard, après avoir rapporté une sensation de picotements aux 2 pieds, il avait reçu un diagnostic de fibrillation auriculaire. Quatre ans après la consultation initiale, il avait aussi signalé une insensibilité ascendante progressive entraînant une instabilité de la démarche. Des études de conduction nerveuse et une électromyographie avaient révélé à ce moment une neuropathie bilatérale des nerfs médians des poignets (grave à droite et modérée à gauche) et une polyneuropathie axonale sensorimotrice symétrique dépendante de la longueur des fibres. Malgré un dégagement du canal carpien droit, les symptômes ne se sont pas résorbés.
Le patient a été aiguillé vers un neurologue; à l’examen physique, le signe de Romberg était positif et le patient n’avait aucune sensibilité proprioceptive des orteils, il présentait une perte sensorielle distribuée « en chaussettes » jusqu’à la mi-jambe, une absence des réflexes dans les membres inférieurs, et une cote de 5/5 pour la force musculaire proximale et de 4/5 pour la force musculaire distale. Les examens de dépistage de la neuropathie axonale acquise (tableau 1) n’ont révélé aucune particularité. Un an plus tard, la neuropathie du patient s’était aggravée au point de l’obliger à utiliser un déambulateur pour se déplacer. Il avait également commencé à avoir des selles aqueuses non sanglantes en alternance avec de la constipation.
Tableau 1:Diagnostic différentiel de la polyneuropathie axonale acquise, analyses sanguines potentielles correspondantes et résultats de notre patient
Un dépistage génétique de neuropathies héréditaires a révélé un variant pathogène concordant avec l’amyloïdose héréditaire à transthyrétine. Le patient a commencé à recevoir de l’inotersen (un oligonucléotide antisens inhibant la synthèse de la transthyrétine par le foie) pour traiter sa polyneuropathie. Il a alors noté une atténuation de ses symptômes neuropathiques et une amélioration de son équilibre, mais l’examen neurologique n’a révélé aucun changement. Il a ensuite rencontré un généticien, qui a découvert lors de l’anamnèse des antécédents de maladie neurologique et cardiaque chez le père et l’oncle.
Une fraction d’éjection de 38 %, une hypertrophie septale asymétrique et un rehaussement diffus et tardif évoquant une amyloïdose cardiaque ont été détectés à l’imagerie par résonance magnétique (IRM) (figure 1). Le patient a alors rencontré un cardiologue, qui n’a recommandé aucun traitement spécifique contre l’amyloïdose cardiaque. Six mois après le diagnostic d’amyloïdose héréditaire à transthyrétine, une orthopnée et une dyspnée d’effort évolutives sont apparues; nous l’avons hospitalisé des mois plus tard pour une anasarque secondaire à une insuffisance cardiaque décompensée, des saignements gastrointestinaux et un déclin fonctionnel marqué.
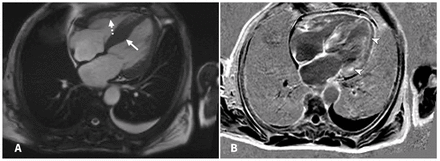
 Figure 1:
Figure 1: Imagerie par résonance magnétique (IRM) du cœur d’un homme de 65 ans atteint d’insuffisance cardiaque décompensée et de neuropathie. Une IRM cardiaque de la voie d’éjection ventriculaire gauche (4 chambres) utilisant des séquences de précession libre à l’état d’équilibre (A) montre une dilatation du ventricule gauche avec une hypertrophie asymétrique (flèche pleine) et une hypertrophie du ventricule droit (flèche pointillée). Une IRM avec injection tardive de gadolinium de la voie d’éjection ventriculaire gauche (4 chambres) (B) montre un rehaussement diffus et tardif (pointes de flèche).
À son admission, le taux d’hémoglobine du patient était de 49 g/L. Une endoscopie haute a révélé une gastropathie d’hypertension portale et une œsophagite dans l’œsophage distal graves. Nous avons traité le patient avec du pantoprazole intraveineux administré 2 fois par jour et des transfusions. Aucun nouveau saignement n’est survenu durant le reste de son séjour à l’hôpital.
L’électrocardiographie a révélé un faible voltage aux dérivations des membres (figure 2), et l’échocardiographie transthoracique a montré un épaississement septal accru (figure 3). Une légère absorption diffuse du traceur par le myocarde évoquant une amyloïdose cardiaque a été observée à la scintigraphie au pyrophosphate. Durant l’hospitalisation, le service de cardiologie a déterminé que, compte tenu des symptômes de classe IV selon la New York Heart Association (NYHA), le patient était peu susceptible de tirer des bienfaits du tafamidis. Nous l’avons donc traité avec des diurétiques et lui avons prescrit un traitement standard contre l’insuffisance cardiaque à son congé. Une IRM subséquente a révélé une réduction de la fraction d’éjection à 24 %. Nous avons donc commencé à administrer au patient du sildénafil topique contre les symptômes neuropathiques vasomoteurs, ce qui l’a soulagé. Il continue de vivre en autonomie, malgré des symptômes de classe III selon la NYHA.
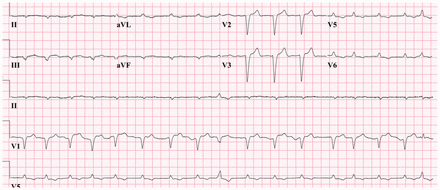
 Figure 2:
Figure 2: Électrocardiogramme montrant une fibrillation auriculaire et un bas voltage aux dérivations des membres, une caractéristique fréquente de l’amyloïdose2.
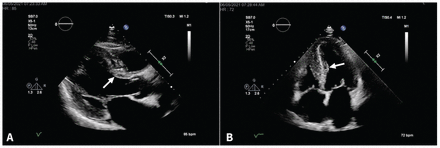
 Figure 3:
Figure 3: Échocardiogramme transthoracique (vue parasternale en axe longitudinal [A] et vue apicale des 4 chambres [B]) montrant un épaississement septal (flèches).
DiscussionLe syndrome du canal carpien est la manifestation initiale la plus courante de l’amyloïdose héréditaire à transthyrétine2. Cependant, il s’agit aussi de la mononeuropathie la plus fréquente au sein de la population générale3, et seul un faible pourcentage des personnes atteintes est aussi atteint d’amyloïdose (tableau 2). Par conséquent, il peut être difficile de déterminer qui, parmi les personnes atteintes d’un syndrome du canal carpien, devrait faire l’objet d’un dépistage de l’amyloïdose.
Tableau 2:Causes du syndrome du canal carpien4
Le diagnostic du syndrome peut être posé cliniquement chez la patientèle présentant les signes et symptômes classiques. Les professionnels de la santé doivent toutefois envisager l’amyloïdose chez les personnes chez qui les 2 poignets sont touchés, qui ont subi de multiples dégagements du canal carpien ou chez qui les dégagements se sont avérés inefficaces2. Une échographie du nerf médian peut aider à dépister les cas de syndrome du canal carpien liés à l’amyloïdose héréditaire à transthyrétine. Dans les cas s’accompagnant d’une amyloïdose héréditaire à transthyrétine, l’aire transversale du nerf médian du poignet pourrait ne présenter aucune augmentation, contrairement aux cas de syndrome non associé à une amyloïdose. Un décalage entre la gravité électrodiagnostique des études de conduction nerveuse et l’échographie de l’aire transversale évoque donc l’amyloïdose3.
Lorsque l’on soupçonne une amyloïdose à transthyrétine chez une personne atteinte d’un syndrome du canal carpien, il peut être utile d’effectuer une biopsie du tissu ténosynovial lors du dégagement du canal carpien. Dans le cadre d’une analyse rétrospective portant sur 126 788 patientes et patients soumis à un dégagement du doigt à ressort ou du canal carpien, le diagnostic d’amyloïdose avait une incidence cumulative sur 10 ans de 0,26 % (intervalle de confiance à 95 % 0,18 %–0,34 %) chez la patientèle traitée pour le doigt à ressort seulement, de 0,6 % chez la patientèle traitée pour le canal carpien et de 0,8 % chez la patientèle traitée pour les 2 troubles, comparativement à 0,053 % chez les témoins appariés5. Sood et ses collègues ont conçu un nomogramme pour prédire le risque d’amyloïdose sur 10 ans et pour guider les décisions en matière de biopsie de tissu ténosynovial lors du dégagement du canal carpien; les facteurs de risque sont l’âge avancé, le sexe masculin, la race, le myélome multiple, la polyarthrite rhumatoïde, la fibrillation auriculaire, la sténose vertébrale et les antécédents de dégagement bilatéraux des canaux carpiens5.
L’amyloïdose est un trouble causé par un repliement anormal des protéines et leur accumulation subséquente dans les tissus6. Les 2 types d’amyloïdose systémique les plus courants sont l’amyloïdose à transthyrétine et l’amyloïdose à chaînes légères. L’amyloïdose à transthyrétine se présente sous 2 formes: l’amyloïdose héréditaire à transthyrétine, dont les symptômes apparaissent entre 30 et 50 ans, et l’amyloïdose à transthyrétine acquise (sauvage), qui se manifeste surtout chez les personnes âgées7.
L’amyloïdose héréditaire à transthyrétine est rare; sa prévalence et son phénotype dépendent du variant génétique identifié6,7. Il existe 3 phénotypes prédominants: la neuropathie, la myocardiopathie et l’atteinte leptoméningée6,7. Chez 80 % des personnes atteintes, la neuropathie est la première manifestation de la maladie et comprend, entre autres, la mononeuropathie, comme le syndrome du canal carpien (qui précède généralement de 6–10 ans les symptômes cardiaques), la polyneuropathie sensorimotrice dépendante de la longueur des fibres et les neuropathies autonomes et des petites fibres6,7. La neuropathie autonome peut provoquer une hypotension orthostatique, un changement des habitudes intestinales, une rétention urinaire, une satiété précoce et un dysfonctionnement érectile7. Une atteinte cardiaque est présente chez environ 40 % de la patientèle atteinte d’amyloïdose à transthyrétine et entraîne une insuffisance cardiaque congestive avec fraction d’éjection préservée. Les personnes touchées peuvent aussi présenter une arythmie, particulièrement une fibrillation auriculaire, un bloc auriculo-ventriculaire et des douleurs thoraciques6. L’échocardiographie montre généralement un épaississement des parois du ventricule gauche et du septum interatrial, des pressions de remplissage ventriculaire gauche élevées et une fonction diastolique normale à réduite; dans la forme avancée de la maladie, la fonction systolique peut également être perturbée8. L’IRM cardiaque montre souvent un épaississement du myocarde et un rehaussement diffus et tardif après l’injection de gadolinium7. Certaines manifestations rares causées par l’atteinte leptoméningée sont les convulsions, les accidents vasculaires cérébraux (AVC) et la démence6.
Le variant p.Thr80Ala, détecté chez notre patient, entraîne principalement des cardiopathies accompagnées d’une neuropathie autonome (75 % des cas); seulement 25 % des cas présenteront une neuropathie sensorimotrice notable9. Le pronostic de la maladie cardiaque chez les personnes présentant le variant p.Thr80Ala est plus sombre que pour les autres variants pathogènes9.
L’examen de référence pour diagnostiquer l’amyloïdose héréditaire à transthyrétine est une biopsie, préférablement du tissu adipeux sous-cutané de l’abdomen; en raison de la distribution fragmentaire des dépôts amyloïdes, on recommande d’effectuer des prélèvements à 2 endroits2,6,8. En microscopie sous lumière polarisée, la coloration au rouge Congo permet de voir des fibrilles amyloïdes à biréfringence vert pomme2,6. Les personnes atteintes de neuropathie chez qui l’on soupçonne une amyloïdose héréditaire à transthyrétine devraient faire l’objet d’un séquençage du gène TTR. En cas de détection d’un variant pathogène ou potentiellement pathogène, ces personnes doivent recevoir des conseils génétiques, et on doit proposer un dépistage génétique en cascade des membres de la famille à risque8. On recommande de confirmer le diagnostic par une biopsie, car la pénétrance peut être incomplète chez les personnes qui possèdent l’allèle à risque8.
Chez la patientèle présentant des symptômes cardiaques et des résultats aux échocardiographies ou aux IRM cardiaques évoquant une amyloïdose et chez qui on a exclu l’amyloïdose à chaînes légères (c.-à-d., une électrophorèse des protéines et un ratio de chaînes légères libres normaux), la scintigraphie au pyrophosphate sans biopsie montrant une absorption du traceur par le myocarde permet de confirmer le diagnostic8,10. En présence d’une amyloïdose à chaînes légères, il faut confirmer le diagnostic par une biopsie8.
Les patientes et patients doivent être aiguillés vers la spécialité appropriée à leurs manifestations (p. ex., cardiologie, neurologie)10. Il est recommandé de réaliser un test de la fonction rénale, une électrocardiographie, un dosage du peptide natriurétique de type B et des troponines ainsi qu’un test de marche de 6 minutes comme examens initiaux10. On recommande également d’effectuer une électrocardiographie tous les 6 mois pour le dépistage des troubles de conduction du système10. Il faut aussi effectuer, 1 fois par année, des examens de conduction nerveuse et un échocardiogramme pour évaluer l’évolution de la maladie10. En cas de résultat négatif lors de la scintigraphie au pyrophosphate, celle-ci peut être répétée 3 ans plus tard si on note un épaississement de la paroi du myocarde lors d’un échocardiogramme ou d’une IRM cardiaque10. Lorsqu’on soupçonne une atteinte rénale causée par l’amyloïdose à transthyrétine, il faut demander une analyse de la fonction rénale ainsi qu’un dosage de l’albumine et des protéines urinaires10.
Les 2 médicaments envisagés pour notre patient étaient l’inotersen et le tafamidis. Nous avons prescrit l’inotersen en raison de la polyneuropathie considérable du patient. Il a été démontré que l’inotersen inhibe la production de la transthyrétine par le foie, ralentit la progression de la maladie et améliore la qualité de vie des patients atteints de polyneuropathie6. Dans une étude de petite envergure, l’inotersen pourrait être sûr chez la patientèle atteinte d’une myocardiopathie associée à une amyloïdose à transthyrétine, mais il n’a pas été approuvé pour cette indication11. Quant au tafamidis, qui stabilise le tétramère de la transthyrétine et prévient le repliement anormal de la protéine, il a été approuvé pour le traitement de l’amyloïdose à transthyrétine, et des études ont montré qu’il améliore la survie et réduit les hospitalisations pour des troubles cardiovasculaires chez la patientèle qui présente des symptômes de classe I et II selon la NYHA12. Aucun bienfait n’a toutefois été observé pour la patientèle qui présente des symptômes de classe III12.
ConclusionLe nombre de personnes atteintes d’amyloïdose à transthyrétine est en hausse, car la maladie est plus couramment envisagée et des analyses de confirmation sont plus souvent prescrites. Les professionnels de la santé doivent envisager ce diagnostic chez les patientes et patients qui présentent des symptômes compatibles avec la maladie, puisque de nouveaux traitements efficaces permettant de ralentir sa progression et de maintenir la qualité de vie sont maintenant accessibles.
RemerciementsLes auteurs remercient Christopher Nolan et Brett Memauri pour leur aide à l’obtention des images d’échocardiographie et d’IRM, respectivement, présentées dans le présent rapport.
FootnotesIntérêts concurrents: Patrick Frosk déclare avoir reçu une subvention de la Fondation canadienne pour l’innovation et de Recherche Manitoba afin de créer des outils informatiques pour la recherche génétique, sans lien avec le présent article, et déclare recevoir du financement de Doctors Manitoba pour une formation médicale continue. Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Les auteurs ont obtenu le consentement du patient.
Collaborateurs: Tous les auteurs ont contribué à la conception du travail, ont rédigé le manuscrit et en ont révisé de façon critique le contenu intellectuel important; ils ont donné leur approbation finale pour la version destinée à être publiée et assument l’entière responsabilité de tous les aspects du travail.
This is an Open Access article distributed in accordance with the terms of the Creative Commons Attribution (CC BY-NC-ND 4.0) licence, which permits use, distribution and reproduction in any medium, provided that the original publication is properly cited, the use is noncommercial (i.e., research or educational use), and no modifications or adaptations are made. See: https://creativecommons.org/licenses/by-nc-nd/4.0/
留言 (0)