La stimulation magnétique transcrânienne répétitive (SMTr) est une technique de stimulation cérébrale non effractive utilisée pour traiter divers troubles de santé mentale, dont le tabagisme.
Le premier appareil SMTr pour le traitement à court terme du sevrage tabagique a été approuvé par Santé Canada en 2022.
La procédure est sûre, généralement bien tolérée, et constitue une nouvelle option de traitement alternatif pour les personnes qui souhaitent arrêter de fumer.
Au Canada, 10,3 % de la population s’adonne au tabagisme1. Chaque année, 8 millions de décès dans le monde sont attribués au tabac2. À l’heure actuelle, 3 pharmacothérapies sont approuvées au pays pour l’abandon du tabagisme: la varénicline, le bupropion, et la thérapie de remplacement de la nicotine (TRN). Bien que ces traitements soient efficaces, de nombreuses personnes n’y répondent pas, et le risque de rechute demeure bien réel. Récemment, un appareil de stimulation magnétique transcrânienne répétitive (SMTr) muni d’un nouveau type de bobine (bobine en H) a été approuvé pour le sevrage tabagique par la Food and Drug Administration des États-Unis (2020) et Santé Canada (2022) (figure 1). Il s’agit du premier appareil de SMTr approuvé pour une telle fin, diverses formes de SMTr étant utilisées depuis des décennies comme traitement de la dépression fondé sur des données probantes3.
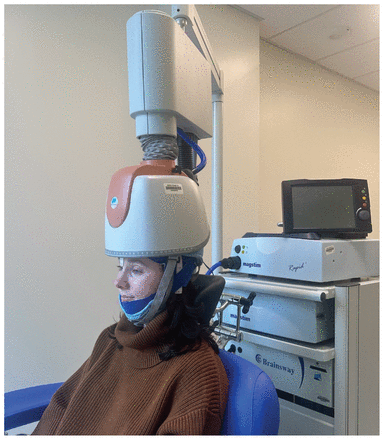
 Figure 1:
Figure 1: Appareil de stimulation magnétique transcrânienne répétitive profonde muni d’une bobine en H actuellement approuvé par Santé Canada pour le traitement du tabagisme, de la dépression, et du trouble obsessionnel-compulsif. La personne s’assoit sur une chaise, et le casque est fixé sur sa tête. La bobine est enchâssée dans le casque, qui est ensuite attaché à un appareil de stimulation et de refroidissement.
En quoi consiste la SMTr?La SMTr est une technique de stimulation cérébrale non effractive qui génère des champs magnétiques à l’aide d’une bobine magnétique pour produire des courants électriques dans une région précise du cerveau. Ces courants provoquent la facilitation (excitation) ou la suppression (inhibition) des neurones situés sous la bobine, ce qui modifie l’activité dans la région cérébrale4. Cette technique peut être appliquée avec différents types de bobines, la plus étudiée étant celle en forme de 8. Cette bobine est efficace pour stimuler les zones superficielles du cortex, comme le cortex préfrontal dorsolatéral. D’autres types de bobines, comme celle en H, ont été conçues pour stimuler des régions corticales plus profondes5, ce qui permet de cibler les régions cérébrales impliquées dans la dépendance, comme l’insula, qui se trouvent sous le cortex superficiel et ne peuvent pas être atteintes par les bobines en forme de 86.
Comment le traitement est-il administré?Le traitement est administré en clinique par du personnel formé. Le protocole de traitement approuvé par Santé Canada consiste en 15 séances quotidiennes échelonnées sur 3 semaines, suivies d’une séance hebdomadaire pendant 3 semaines (figure 2). Au début du premier traitement, un ou une médecin déterminera le seuil moteur au repos (SMR) de la personne. Le SMR permet de connaître l’intensité minimale nécessaire pour activer un muscle (l’abductor pollicis brevis droit) dans la main de la personne par la stimulation du cortex moteur. L’intensité ciblée de la stimulation pour toutes les séances de traitement est établie à 120 % du SMR. Avant chaque séance, la personne subit un bref test de provocation de la dépendance au tabac pour activer les circuits cérébraux impliqués dans la dépendance. On lui demande de tenir une cigarette et un briquet tout en imaginant se trouver dans une situation où elle serait normalement en train de fumer. Chaque séance dure 25–30 minutes au total, ce qui comprend le test de provocation, 18 minutes de stimulation magnétique transcrânienne (SMT) et une courte séance de counseling.
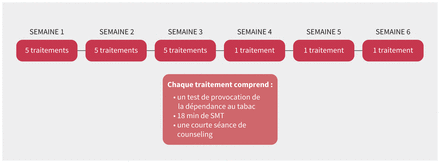
 Figure 2:
Figure 2: Protocole de traitement par stimulation magnétique transcrânienne répétitive (SMTr) pour l’abandon du tabagisme.
Quelles sont les données probantes appuyant l’usage de la SMTr pour l’abandon du tabagisme?La plupart des études évaluant la SMTr comme thérapie antitabagique se sont penchées sur les effets générés lorsqu’on cible le cortex préfrontal dorsolatéral à l’aide de bobines en forme de 8. Ces études de moindre envergure ont rapporté des résultats mitigés et non concluants7. Depuis 2014, la bobine H4 — une bobine en H qui cible l’insula et le cortex préfrontal de façon bilatérale — a été utilisée dans 2 essais cliniques. Comme ces 2 essais ont généré des résultats positifs, la bobine H4 est la seule à avoir été approuvée par Santé Canada pour l’abandon du tabagisme. Le premier essai, mené auprès de 115 personnes chez qui la pharmacothérapie n’avait pas fonctionné, a été réalisé selon une approche randomisée, contrôlée et à triple insu. La stimulation à haute fréquence (10 Hz) avec exposition à des stimuli liés au tabagisme a été associée à des taux d’abstinence supérieurs à la fin du traitement (43,75 %), comparativement à la stimulation factice (13,3 %) (p = 0,039). Elle a aussi mené à une réduction significative de la consommation de cigarettes et de la dépendance à la nicotine à la fin du traitement. Aucune différence n’a été constatée entre la stimulation à basse fréquence et la stimulation factice (p = 0,94). Six mois après le traitement, le taux d’abstinence était descendu à 33 % dans le groupe ayant subi la stimulation à haute fréquence et n’était alors plus significatif (p = 0,06)8.
Un essai multicentrique a été mené subséquemment auprès de 262 personnes fumeuses. Bien que la participation préalable à un essai de pharmacothérapie à des fins de sevrage tabagique n’était pas un critère d’inclusion, toutes les personnes participantes avaient déjà tenté une pharmacothérapie, sans succès. La stimulation à haute fréquence (10 Hz) avec exposition à des stimuli liés au tabagisme a entraîné un taux d’abstinence sur 4 semaines de 25,3 % (intention de traiter 17,6 %), comparativement à un taux de 6,4 % (intention de traiter 4,8 %) dans le groupe témoin (traitements effectués au complet p = 0,0006; intention de traiter p = 0,002) à la fin du traitement. Les personnes abstinentes à la fin du traitement ont été suivies pendant 18 semaines, et on a observé des taux plus élevés d’abandon du tabagisme dans le groupe traité que dans le groupe témoin (traitements effectués au complet 28 % c. 11,7 %, p = 0,007; intention de traiter 19,4 % c. 8,7 %, p = 0,017)9.
De leur côté, les traitements de première intention comme la varénicline, le bupropion, et la TRN sont associés à des taux d’abstinence après 6 mois de 21,8 %, 16,2 %, et 15,7 %, respectivement10. Les traitements de seconde intention, comme les thérapies combinant la varénicline et la TRN, affichent un taux d’abstinence de 32,4 % après 6 mois11. Ces thérapies combinées nécessitent 12 semaines de traitement, tandis que la SMT profonde en nécessite 6. Cela dit, les options pharmacologiques ont été étudiées exhaustivement, ont peu d’effets indésirables, sont largement accessibles au Canada et peuvent être utilisées à domicile, alors que la SMT profonde nécessite de multiples visites en personne dans une clinique fournissant ce service spécialisé.
Qui est admissible?Les personnes fumant plus de 10 cigarettes par jour depuis plus de 1 an sont admissibles à la SMTr. Il s’agit d’une intervention qui n’est pas indiquée chez les personnes fumeuses qui ont des implants métalliques à l’intérieur ou sur la surface de la tête ou qui portent un appareil électronique implanté, comme un défibrillateur implantable automatique. L’innocuité de la SMTr profonde n’a pas été évaluée chez les personnes fumeuses et qui ont moins de 22 ans ou plus de 68 ans; qui présentent un trouble lié à l’usage de substances psychoactives ou un trouble psychotique, neurologique ou convulsif; qui sont atteintes d’une affection qui accroît leur risque de convulsions; qui portent un appareil électronique implanté; ou encore qui sont enceintes ou qui allaitent. Bien que ces critères d’admissibilité aient une portée générale, en dehors des milieux de recherche, ce sont les médecins ayant suivi une formation sur la SMTr qui doivent déterminer s’il y a lieu de recommander ce traitement selon une évaluation personnalisée des risques et des bienfaits avant de le prescrire12.
Quels sont les risques?La SMTr présente un profil d’effets indésirables généralement favorable. Les effets indésirables les plus fréquents sont les céphalées et la douleur dans la zone traitée, au visage et au cou. Ces symptômes disparaissent habituellement après la séance de traitement12. L’incident thérapeutique le plus grave est la crise de convulsions. Selon un sondage des membres de la Clinical TMS Society (CTMSS) mené en 201813, le taux de crises convulsives est de 0,31 par 10 000 séances de SMTr et de 0,71 par 1000 personnes, peu importe l’appareil. Le taux de crises convulsives chez la patientèle traitée au moyen de l’appareil équipé d’une bobine en H pour d’autres emplois était significativement plus élevé (5,56 par 1000 personnes), probablement en raison de l’intensité du champ électrique induit et de la haute fréquence de la stimulation des bobines en H par rapport aux autres bobines. Les convulsions sont plus susceptibles d’être signalées chez les personnes prenant des doses élevées ou arrêtant subitement la prise de psychotropes (p. ex., clonazépam, amitriptyline), des médicaments connus pour augmenter le risque de crises convulsives. Les convulsions sont aussi plus fréquentes chez les personnes qui consomment de grandes quantités d’alcool dans les 24 heures suivant le traitement, qui modifient subitement et considérablement leur consommation d’alcool de base ou qui sont en sevrage d’alcool. Pour prévenir les convulsions, le SMR devrait être recalculé après tout changement touchant la prise de médicaments13,14. Dans le cadre d’essais où la SMTr était employée pour le sevrage tabagique, aucune des personnes participantes n’a eu de convulsions8,9,15.
Quelles sont les ressources nécessaires pour utiliser la SMTr?Le traitement est administré dans une clinique où travaillent des prestataires de soins de santé ayant la formation et l’expertise requises pour employer la SMTr. Il peut être prodigué par des personnes n’étant pas médecins, mais une surveillance médicale est nécessaire pour la détermination des conditions d’administration et du SMR ainsi que pour la prise en charge de certains effets indésirables, comme les convulsions12. La patientèle peut se voir rembourser les traitements s’ils sont couverts par des régimes d’assurance-maladie complémentaire ou devoir assumer personnellement les frais dans des cliniques privées. Comme l’utilisation de la SMTr pour l’abandon du tabagisme n’a été approuvée que récemment au Canada, seules 6 cliniques offrent actuellement ce traitement: 3 en Colombie-Britannique (Vancouver, Kelowna et Surrey), 1 en Alberta (Edmonton), 1 au Québec (Montréal) et 1 en Ontario (Ottawa).
Que nous réserve l’avenir?Étant donné le faible nombre de cliniques offrant le SMTr pour l’abandon du tabagisme et les données probantes limitées aux essais cliniques menés en milieu de recherche, la prochaine étape consistera à analyser les résultats cliniques en contexte réel de la SMTr utilisée pour le sevrage tabagique ainsi que le rapport coût–efficacité du traitement. Étant donné son coût et le fait qu’elle nécessite des visites en personne, la SMTr pourrait ne pas convenir comme thérapie de première intention; elle serait plutôt indiquée pour les personnes n’ayant pas réussi à arrêter de fumer après la prise de médicaments. Par ailleurs, ce traitement n’a pas fait l’objet d’études chez toutes les populations, comme les personnes atteintes de schizophrénie, qui présentent des taux élevés de consommation chronique de tabac. Une étude de validation a montré son potentiel d’utilisation chez la patientèle schizophrène16, mais aucun essai de grande envergure visant à déterminer les issues liées à l’abandon du tabagisme n’a été mené pour l’instant.
D’autres études devraient évaluer si les protocoles de traitement combinant la SMTr et les pharmacothérapies antitabagiques peuvent mener à une hausse des taux ou de la longueur des périodes d’abstinence. Notre équipe a récemment réalisé un essai clinique en utilisant une bobine en H différente (ciblant l’insula), combinée à l’administration de varénicline, et a relevé une différence significative entre les groupes en ce qui concerne les taux d’abstinence tabagique (82,4 % pour la stimulation active c. 30,7 % pour la stimulation factice à 3 mois, p = 0,03). Comme pour les essais mentionnés plus haut, cette différence n’était plus significative lors du suivi réalisé après 6 mois15. Ces résultats mettent encore plus en évidence la nécessité de mener d’autres études qui évaluent les protocoles de traitement ciblant l’abstinence à long terme.
FootnotesIntérêts concurrents: Bernard Le Foll déclare avoir reçu du financement de la société Pfizer Inc. (bourses GRAND, y compris un soutien salarial) pour des projets menés à l’initiative de chercheurs, et de la société Indivior pour un essai clinique commandité par la société. Il a reçu des dons en nature sous forme de produits du cannabis de la société Aurora Cannabis Inc., et des dons de médicaments aux fins d’étude des sociétés Pfizer Inc. (varénicline pour l’abandon du tabagisme) et Bioprojet Pharma. Il a aussi reçu une bobine de la société BrainsWay pour une étude sur la stimulation magnétique transcrânienne (SMT). Il a obtenu du financement sectoriel des sociétés Canopy Growth Corporation (dans le cadre de bourses de recherche gérées par le Centre de toxicomanie et de santé mentale [CAMH] et l’Université de Toronto), Bioprojet Pharma, Alkermes et Universal Ibogaine et du regroupement Alcohol Countermeasure Systems. Enfin, il a reçu des dons en nature de nabiximols de la part du laboratoire GW Pharmaceuticals pour des études antérieures financées par les Instituts de recherche en santé du Canada (IRSC) et les National Institutes of Health (NIH) des États-Unis. Par ailleurs, il a participé à une séance de réunion (sur les tendances émergentes liées à la buprénorphine à libération prolongée) d’un comité consultatif national pour la société Indivior Canada et fait partie du comité directeur d’un essai clinique mené pour la société Indivior. Il a également fourni des services de consultation à la société Shionogi. Il est soutenu par le CAMH et le Centre Waypoint de soins de santé mentale, bénéficie d’une bourse de clinicien-chercheur du Département de médecine familiale et communautaire de l’Université de Toronto et est titulaire d’une chaire de recherche en psychiatrie de la dépendance du Département de psychiatrie de l’Université de Toronto. Daniel Blumberger déclare avoir reçu du soutien à la recherche des IRSC, des NIH, de la Fondation Brain Canada et de la famille Temerty par l’entremise de la fondation du CAMH et de l’Institut de recherche en santé mentale de la famille Campbell. Il indique avoir reçu du soutien matériel en nature pour une étude menée par des chercheurs de la société BrainsWay. Il a été chercheur principal sur place de 3 études menées par des commanditaires pour la société BrainsWay. Il a également reçu du soutien matériel en nature de la société MagVenture pour 2 études menées par des chercheurs ainsi que des médicaments pour un essai mené par des chercheurs de la société Indivior. Il a aussi été coprésident du comité de normes cliniques de la société Clinical TMS (aucune rémunération) et président du comité consultatif sur les techniques de neurostimulation du Centre d’excellence pour la santé mentale et la lutte contre les dépendances, en Ontario (aucune rémunération). Victor Tang a reçu du financement de recherche de la Fondation de recherche sur le cerveau et les comportements, de la fondation Physician Services Incorporated, du Réseau familial Labatt pour la recherche sur la biologie de la dépression (tous les versements ont été faits à l’établissement) et du Programme de bourses de recherche en médecine des toxicomanies (R25DA033211) de l’Institut national sur les toxicomanies (les versements ont été faits au Dr Tang). Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Les auteurs ont obtenu le consentement de la patiente.
Collaborateurs: Tous les auteurs ont contribué à l’élaboration et à la conception du travail. Christine Ibrahim a rédigé la première version du manuscrit. Daniel Blumberger, Victor Tang et Bernard Le Foll en ont révisé de façon critique le contenu intellectuel important. Tous les auteurs ont approuvé la version finale pour publication et assument l’entière responsabilité de tous les aspects du travail.
This is an Open Access article distributed in accordance with the terms of the Creative Commons Attribution (CC BY-NC-ND 4.0) licence, which permits use, distribution and reproduction in any medium, provided that the original publication is properly cited, the use is noncommercial (i.e., research or educational use), and no modifications or adaptations are made. See: https://creativecommons.org/licenses/by-nc-nd/4.0/
留言 (0)