L’œsophagite à éosinophiles est une maladie inflammatoire chronique qui affecte autant les enfants que les adultes et dont l’incidence et la prévalence sont en hausse partout dans le monde; la maladie est fréquente chez les jeunes hommes qui ont des antécédents d’atopie.
La physiopathologie met en cause une interaction entre l’exposition à des antigènes et des facteurs propres à l’hôte, notamment des variations génétiques spécifiquement œsophagiennes.
Les adultes qui souffrent d’œsophagite à éosinophiles présentent souvent une dysphagie récurrente et une impaction du bol alimentaire qui peuvent être masquées par des comportements compensatoires, tandis que les enfants présentent plus de problèmes à s’alimenter, de douleurs abdominales et de vomissements.
Le diagnostic de l’œsophagite à éosinophiles se fonde sur l’anamnèse clinique et sur l’inflammation, principalement éosinophilique, à l’examen histologique des biopsies effectuées lors d’une endoscopie.
Le traitement de première intention peut inclure des agents pharmacologiques ou des régimes d’élimination en conjonction avec une dilatation œsophagienne au besoin pour corriger et prévenir les obstructions alimentaires.
L’œsophagite à éosinophiles est une maladie chronique qui peut affecter autant les enfants que les adultes et qui englobe divers problèmes, car il s’agit d’une cause fréquente de dysphagie œsophagienne, de sténose œsophagienne et d’impaction du bol alimentaire1–6. Comme elle est de plus en plus souvent observée depuis une trentaine d’années2, nous abordons les données les plus récentes sur l’œsophagite à éosinophiles, ainsi que les recommandations pour sa prise en charge tirées des lignes directrices consensuelles actuelles (encadré 1).
Encadré 1: Données utilisées pour la présente revueNous avons interrogé la base de données PubMed pour repérer les articles publiés de 2013 à mai 2023, et plus particulièrement à partir de 2018 lorsque les critères diagnostiques de l’œsophagite à éosinophiles ont changé. Les articles retenus incluaient des lignes directrices, des méta-analyses et des essais randomisés contrôlés.
Qui est sujet à l’œsophagite à éosinophiles?Même si l’œsophagite à éosinophiles affecte les personnes de tous âges, on note des taux plus élevés dans les groupes de 5–14 ans et de 20–45 ans et sa prévalence est plus élevée sous les climats froids7. Les hommes sont 3–4 fois plus susceptibles d’en souffrir que les femmes1 et les antécédents familiaux ou personnels d’inflammation de type 2 sont fréquents (p. ex., asthme, dermatite atopique)8–10. Une multiplication du risque par un facteur de 64 dans les fratries est un signe de composante héréditaire11.
La plupart des estimations de l’incidence et de la prévalence de l’œsophagite à éosinophiles proviennent de données sur des populations en majeure partie blanches7,12,13. L’incidence (5–20 nouveaux cas par 100 000 de population annuellement) et la prévalence (9,5–58,9 adultes par 100 000 personnes)12–15 les plus élevées ont été rapportées en Amérique du Nord et en Europe. Une étude de population de Calgary a révélé qu’entre 2004 et 2008, l’incidence a augmenté de 2,1 à 10,7 cas par 100 000 de population et la prévalence, de 10,7 à 33,7 par 100 000 personnes16. Dans la région de Castille-La Manche, en Espagne, entre 2011 et 2017, l’incidence est restée stable à 10 cas par 100 000 de population, mais la prévalence est passée de 44,6 à 111,9 par 100 000 personnes17. Les facteurs qui contribuent au fardeau croissant de la maladie pourraient inclure une plus grande sensibilisation à l’existence de l’œsophagite à éosinophiles et l’évolution des critères diagnostiques7,12–19.
Quelle en est la physiopathologie?La physiopathologie de l’œsophagite à éosinophiles repose sur une interaction encore mal comprise entre l’exposition à des antigènes et des facteurs propres à l’hôte, y compris des variations génétiques spécifiques à l’œsophage (figure 1). Au sein des familles, certaines configurations génétiques laissent supposer une transmission héréditaire complexe11,20. Une perturbation de la barrière épithéliale œsophagienne semble agir comme déclencheur3,20. L’exposition à des antigènes alimentaires ou environnementaux induit une régulation à la hausse des cytokines qui participent à l’atopie et aboutit à une réaction en cascade des cytokines inflammatoires, ce qui favorise l’expression d’un important groupe de gènes appelé transcriptome de l’œsophagite à éosinophiles11,20. La migration subséquente des éosinophiles et autres cellules inflammatoires dans la paroi de la lumière œsophagienne provoque une cascade inflammatoire. Avec le temps, cette cascade cause une atteinte transmurale de l’œsophage accompagnée de fibrose, d’un rétrécissement de la lumière œsophagienne et de sténoses œsophagiennes (figure 1)21. Certains des gènes en cause participent aussi à la sensibilisation allergique et à l’inflammation de type 2, comme l’asthme, la dermatite atopique et la rhinite allergique11,20,22.
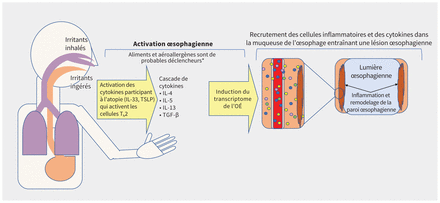
 Figure 1:
Figure 1: Physiopathologie de l’œsophagite à éosinophiles (OÉ). Remarque: IL = interleukine, TGF-β = facteur de transformation de type bêta, Th2 = lymphocytes T auxiliaires, TSLP = lymphopoïétine stromale thymique. *Les aéroallergènes déclencheurs ne sont pas bien établis.
Quel est le tableau clinique de l’œsophagite à éosinophiles?La dysphagie est le symptôme le plus fréquent de l’œsophagite à éosinophiles1–3. Dans bien des cas, les personnes consultent initialement pour une obstruction du bol alimentaire au niveau de l’œsophage, habituellement avec une incapacité d’avaler la salive6,23. Les personnes peuvent s’étouffer facilement, avoir des haut-le-cœur ou régurgiter en raison d’une obstruction réelle ou perçue24. Les enfants sont plus susceptibles de présenter des symptômes vagues, tels que douleurs abdominales, reflux, perte d’appétit, toux chronique, retard de croissance ou vomissements25. La plupart des cas (75 %) présentent au moins une maladie atopique, notamment des allergies alimentaires ou environnementales, une dermatite atopique, une rhinite allergique, des polypes nasaux ou de l’asthme8–10. Certains manifestent aussi une variabilité saisonnière de leurs symptômes, l’intensité étant moindre au cours des mois d’hiver26. L’œsophagite à éosinophiles est plus souvent diagnostiquée l’été, ce qui rappelle le rôle des aéroallergènes déclencheurs26,27.
On observe souvent des comportements adaptatifs et de l’anxiété autour des repas. Parfois, les personnes boivent beaucoup pour faciliter la déglutition, coupent leurs aliments en petites bouchées et évitent les aliments consistants. Les repas sont plus longs à prendre et la mastication semble excessive. La plupart des personnes concernées évitent de prendre des médicaments en comprimés. L’acronyme de langue anglaise IMPACT est utile au moment de l’anamnèse (encadré 2)3. En dépit des symptômes, il peut s’écouler jusqu’à 10 ans avant que le diagnostic ne soit finalement posé, ce qui accroît le risque de fibrose œsophagienne5.
Encadré 2: Acronyme de langue anglaise IMPACT pour l’anamnèse en présence d’une œsophagite à éosinophiles présuméeImbibing fluids with meals to lubricate foods (Prise de liquides avec les repas pour humecter les aliments)
Modifying food (cutting into small pieces) (Modifications de l’alimentation [couper les aliments en petites bouchées])
Prolonged meal times (Prolongation des temps de repas)
Avoidance of hard textured foods (e.g., bread, meats) (Évitement des aliments consistants [p. ex., pain, viande])
Chewing excessively (Mastication excessive)
Turning away pills (Évitement des comprimés)
Comment la maladie est-elle diagnostiquée?Les diagnostics différentiels de la dysphagie œsophagienne chronique incluent les sténoses œsophagiennes induites par le reflux gastro-œsophagien (RGO), les troubles de la motilité œsophagienne, comme l’achalasie, et les troubles alimentaires.
Il est parfois difficile de distinguer l’œsophagite à éosinophiles du RGO1,28,29. À l’endoscopie, la prévalence de l’œsophagite est similaire (46 % pour l’œsophagite à éosinophiles c. 56 % pour le RGO)28. Toutefois, une étude cas–témoins rétrospective a permis de dégager certains prédicteurs qui pointent en direction de l’œsophagite à éosinophiles plutôt que du RGO: jeune âge, sexe masculin, symptômes de dysphagie et allergies alimentaires28. L’absence de hernie hiatale et d’anneaux, sillons, plaques ou exsudats œsophagiens était plus probable à l’endoscopie en présence d’œsophagite à éosinophiles28.
Pour distinguer l’œsophagite à éosinophiles des troubles de motilité ou alimentaires, les médecins doivent être à l’affût de certains signes annonciateurs, tels que perte de poids et malnutrition30,31. Le diagnostic de trouble de la motilité repose normalement sur la manométrie œsophagienne, puisqu’à l’endoscopie, certaines anomalies pourraient être absentes32. Les troubles alimentaires sont également difficiles à distinguer de l’œsophagite à éosinophiles parce que les comportements alimentaires restrictifs, y compris l’aversion à certains aliments, l’anxiété au moment des repas et un certain type de mastication, peuvent accompagner les 2 maladies. Un historique alimentaire détaillé est essentiel pour vérifier quels types d’aliments sont évités et pourquoi30. Les personnes atteintes d’œsophagite à éosinophiles peuvent éviter la viande et le pain parce qu’elles se sont déjà étouffées, tandis que celles qui ont un trouble alimentaire les évitent en raison de leur teneur calorique.
Le diagnostic de l’œsophagite à éosinophiles se fonde sur l’histoire clinique de la dysfonction œsophagienne et des biopsies de l’œsophage montrant à la cytologie une inflammation surtout éosinophilique (≥ 15 éosinophiles/champ à fort grossissement) (figure 2)1–4,6. L’aspect de l’œsophage à l’endoscopie peut varier et ne fait pas partie des critères diagnostiques1,23. Auparavant, on demandait l’essai d’un inhibiteur de la pompe à protons (IPP), mais ce critère a été abandonné en 20182. D’autres causes potentielles des symptômes et de l’éosinophilie œsophagienne doivent être écartées avant que le diagnostic d’œsophagite à éosinophiles puisse être posé (figure 2 et encadré 3)1,2,4.
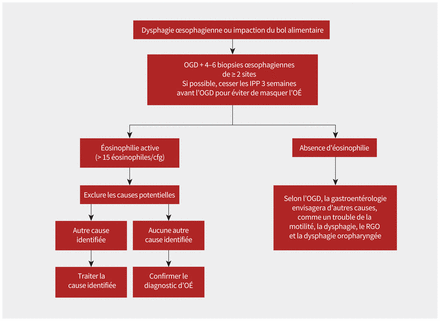
 Figure 2:
Figure 2: Diagramme pour guider le diagnostic de l’œsophagite à éosinophiles (OÉ). Remarque: Cfg = champ de fort grossissement, IPP = inhibiteur de la pompe à protons, OGD = œsophagogastroduodénoscopie, RGO = reflux gastro-œsophagien.
Encadré 3: Maladies qui peuvent s’accompagner d’éosinophilie lors de biopsies de l’œsophage1Œsophagite à éosinophiles
Gastrite, gastroentérite ou colite à éosinophiles avec atteinte œsophagienne
Reflux gastro-œsophagien
Achalasie et autres dysmotilités œsophagiennes
Syndrome hyperéosinophilique
Maladie de Crohn avec atteinte œsophagienne
Infections (fongique, virale)
Troubles des tissus conjonctifs
Syndromes d’hypermobilité
Vascularites et troubles auto-immuns
Maladies dermatologiques et atteinte œsophagienne (p. ex., pemphigus)
Hypersensibilité aux médicaments
Œsophagite associée à la prise de médicaments oraux
Réaction du greffon contre l’hôte
Troubles mendéliens (p. ex., syndrome de Marfan de type 2, syndrome hyper-IgE, syndrome tumoral hamartomateux lié au gène PTEN, syndrome de Netherton, cachexie liée à une atopie grave)
Une ligne directrice de pratique clinique de 2022 provenant du Royaume-Uni suggère la suspension des IPP pendant au moins 3 semaines avant l’endoscopie pour éviter de masquer les signes d’œsophagite à éosinophiles6, tandis que d’autres lignes directrices n’en font pas mention (figure 2)2,4,23. Il faut procéder à des biopsies au moment de l’endoscopie parce que l’œsophagite à éosinophiles a un aspect normal dans 10 %–32 % des cas1,23. Et étant donné ses signes endoscopiques et histologiques variables, il faut prélever 4–6 échantillons à partir d’au moins 2 sites différents (œsophage proximal, moyen et distal)1,4,23. Selon plusieurs études, la sensibilité diagnostique augmente avec le nombre de biopsies23. La répartition des biopsies montrant des nombres élevés d’éosinophiles dans tout l’œsophage peut aider à distinguer l’œsophagite à éosinophiles du RGO en présence d’autres facteurs cliniques. L’œsophagite à éosinophiles tend à affecter plusieurs sites, tandis que le RGO s’accompagne d’éosinophilie à la portion inférieure de l’œsophage. Une fois le diagnostic d’œsophagite à éosinophiles confirmé, la gastroentérologie fera un suivi au cours des quelques semaines suivantes pour parler du diagnostic et amorcer un traitement.
Prise en charge de l’œsophagite à éosinophilesSelon les lignes directrices actuelles, on optera soit pour une pharmacothérapie, soit pour une diétothérapie4,6,23,33,34. La dilatation est parfois requise pour traiter la sténose œsophagienne et, dans certains cas, on y a recours en prophylaxie pour prévenir l’obstruction œsophagienne. En langue anglaise, on parle des « 3 D » (drugs, diet, dilation [pharmacothérapie, modifications de l’alimentation et dilatation]). À ce jour, aucun essai randomisé contrôlé n’a fait de comparaison directe pour établir la supériorité de l’une ou l’autre de ces modalités thérapeutiques. De petites études rétrospectives portant sur une diète restrictive et des médicaments ont fait état de bienfaits chez les adultes et les enfants6. Malgré des données de faible qualité6, le consensus pointe en direction d’une association de traitements pharmacologiques et diététiques chez les malades qui répondent plus ou moins bien aux modalités utilisées seules, mais il s’agit d’un domaine de recherche qui évolue6,35.
À partir des lignes directrices actuelles4,6,23,33,34, nous proposons un algorithme à la figure 3. Harmoniser rapidement les options thérapeutiques avec les préférences et les attentes des personnes réduit leur frustration et favorise leur observance thérapeutique3,4,6,33,35. Les recommandations actuelles fondées sur des données probantes préconisent le maintien du traitement une fois la rémission obtenue, aussi longtemps qu’il demeure acceptable pour la personne3,6,23,35. D’autres études seront nécessaires pour vérifier l’innocuité à long terme, la persistance de la réponse au traitement au fil du temps et le recours à un traitement d’entretien de longue durée après la rémission ou en présence de signes légers de la maladie3.
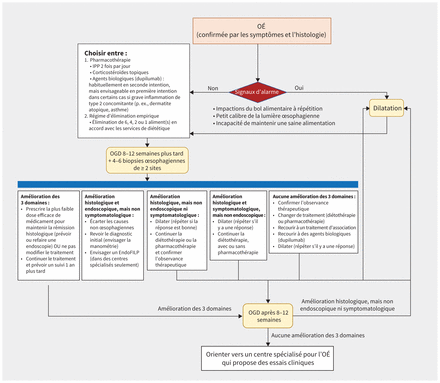
 Figure 3:
Figure 3: Algorithme proposé pour la prise en charge de l’œsophagite à éosinophiles (OÉ) sur la base des lignes directrices et déclarations de consensus actuelles, avec prise en compte des différents résultats des soins de l’OÉ. Le système de planimétrie par impédance EndoFLIP est un nouvel outil qui permet d’évaluer les propriétés mécaniques de la paroi œsophagienne et pourrait jouer un rôle important dans l’évaluation de la fibrose œsophagienne. Remarque: IPP = inhibiteur de la pompe à protons, OGD = œsophagogastroduodénoscopie.
PharmacothérapieLe traitement de première intention est habituellement pharmacologique et peut débuter dès l’obtention des résultats des biopsies œsophagiennes effectuées lors de l’endoscopie initiale (figure 3).
On recommande d’abord les inhibiteurs de la pompe à protons1,2,4,6,23,33. Ils sont faciles à utiliser, économiques et s’accompagnent de relativement peu d’effets indésirables comparativement à d’autres agents1,2,4,6,23,33. Une revue systématique et méta-analyse de 33 études dont la population regroupée totalisait 431 adultes et 188 enfants a fait état de réponses cliniques et histologiques partielles aux IPP chez 60,8 % et 50,5 % de ces populations, respectivement36. Une revue systématique de 2020 a indiqué que la prise d’IPP 2 fois par jour induisait une rémission histologique en l’espace de 4–12 semaines chez 41,7 % des personnes atteintes, contre 13,3 % avec le placebo (risque relatif [RR] 0,66, intervalle de confiance [IC] de 95 % 0,61–0,72)33,34. Selon les métaanalyses, les données probantes sur l’utilisation des IPP sont de très faible qualité, car plus des deux tiers des études étaient des séries ou rapports de cas rétrospectifs peu volumineux36,37.
Les corticostéroïdes topiques peuvent être utilisés chez les personnes qui ne répondent pas aux IPP ou en première intention si la maladie est agressive1,2,6,33,34. Une revue Cochrane conclut que les corticostéroïdes topiques donnent lieu à une rémission clinique, histologique et endoscopique, mais ne se sont pas révélés supérieurs aux IPP2,4,37–41. Ils réduisent l’éosinophilie muqueuse et la formation de sténoses1,3,6,23,33,34,40. C’est pourquoi, dans notre pratique, nous utilisons les corticostéroïdes topiques en traitement de première intention chez les personnes qui ont des symptômes de longue date et un œsophage étroit, posant un risque élevé de fibrose et d’obstruction. Aucune modalité ne s’est révélée supérieure lors de comparaisons directes3,34,37,38. Les corticostéroïdes topiques sont offerts sous forme de nébuliseur de propionate de fluticasone pour prise orale ou sous forme topique orale (budésonide en solution visqueuse ou budésonide en comprimés orodispersibles) (tableau 1). La seule préparation approuvée au Canada pour les adultes (et non les enfants) atteints d’œsophagite à éosinophiles est le budésonide en comprimés orodispersibles39,40. Un essai randomisé contrôlé sur le budésonide (comprimé orodispersible, 1 mg par voie orale 2 fois par jour) a fait état d’une amélioration histologique, endoscopique et symptomatologique dès la 6e semaine chez 58 % des malades, contre 0 % avec le placebo39. Une rémission soutenue (48 semaines) a été observée avec le budésonide (comprimé orodispersible, 0,5 mg ou 1 mg 2 fois par jour) chez 73,5 % des personnes qui recevaient la dose de 0,5 mg et 75 % des personnes qui recevaient la dose de 1 mg, contre 4 % des personnes sous placebo40. Le temps médian avant une récidive a été de 87 jours dans le groupe sous placebo, contre 350 jours dans les groupes traités40. Le risque de candidose orale avec les corticostéroïdes topiques est d’environ 5 %, l’hygiène buccale est donc importante (tableau 1)42.
Tableau 1:Pharmacothérapie de l’œsophagite à éosinophiles
De nouveaux agents biologiques qui ciblent les principaux déclencheurs de l’inflammation de type 2 se sont révélés efficaces pour la prise en charge de l’œsophagite à éosinophiles (figure 3)3,43,44. En mai 2023, le dupilumab (anticorps humain monoclonal anti-interleukine [IL]-4/IL-13) a été approuvé par Santé Canada pour le traitement de l’œsophagite à éosinophiles. Il était déjà approuvé pour la dermatite atopique, la rhinosinusite chronique accompagnée de polypes nasaux et l’asthme43. L’approbation pour l’œsophagite à éosinophiles repose sur un essai randomisé contrôlé qui comparait le dupilumab (300 mg par semaine) au placebo43,44 et qui a fait état d’une amélioration histologique, endoscopique et symptomatologique après 24 semaines (réduction du risque absolu de 55 %, IC de 95 % 40 %–71 %; p < 0,001)43. Soixante pour cent des personnes ayant participé à cette étude avaient déjà utilisé des corticostéroïdes topiques. Après la période initiale de 24 semaines, l’étude comprenait un volet de prolongation à étiquetage en clair de 28 semaines au cours duquel les personnes faisant partie du groupe placebo ont pris le dupilumab chaque semaine et ceux qui avaient initialement reçu le dupilumab continuaient de recevoir la même dose. Après 52 semaines, les personnes qui étaient passées du placebo au dupilumab ont obtenu des taux de rémission similaires (60 %) à ceux qui avaient pris le dupilumab dès le début (55,9 %)44. D’autres anticorps monoclonaux pour des maladies atopiques, comme le mépolizumab, le benralizumab et l’omalizumab, n’ont pas conféré les mêmes avantages pour l’œsophagite à éosinophiles6,33,34.
D’autres médicaments — y compris les corticostéroïdes systémiques, les antagonistes des récepteurs des leucotriènes, la cromolyne sodique et l’anti-immunoglobuline (Ig) E, la mercaptopurine et les agents antifacteur de nécrose tumorale — ont donné des résultats inconstants dans plusieurs études et ne sont pas recommandés pour le traitement de l’œsophagite à éosinophiles4,6,33–35.
DiétothérapieDes modifications à l’alimentation peuvent aider à identifier les déclencheurs alimentaires et à traiter l’œsophagite à éosinophiles (figure 3)3,6,33,45. L’élimination empirique et les régimes élémentaires permettent d’induire la rémission, mais l’observance thérapeutique pose problème45. Il n’est pas recommandé de procéder à des tests d’allergie cutanés ou sanguins IgE-spécifiques pour choisir le type de diétothérapie restrictive parce qu’on note une piètre corrélation avec les déclencheurs et ils ne sont pas utiles dans les cas d’œsophagite à éosinophiles6,45,46. Les régimes alimentaires axés sur les allergies ont une efficacité de 45,5 % sur le plan de la rémission histologique lors d’essais de 2–12 semaines, même si les résultats des études d’une méta-analyse étaient très hétérogènes (I2 = 75 %)46. Ainsi, ces régimes ne sont pas recommandés6,35.
Les régimes d’élimination empiriques prévoient l’évitement de groupes alimentaires connus pour déclencher des symptômes d’atopie. Lors d’études sur des populations pédiatriques, 6 groupes d’allergènes alimentaires ont été associés à l’œsophagite à éosinophiles. Le régime d’élimination de 6 aliments prévoit le retrait du lait de vache, du blé, du soya, des noix, des fruits de mer et des œufs pour ménager l’œsophage. Une revue systématique de 10 études d’observation qui comparaient un régime d’élimination de 6 aliments sur une période de 6 semaines par rapport au placebo a fait état d’une efficacité de 68 %, contre 13 %, respectivement (RR 0,38, IC de 95 % 0,32–0,43)33,34.
Éliminer 6 groupes alimentaires pose un défi, affecte la qualité de vie et peut causer des déficits nutritionnels6,45. Le soutien de diététistes chevronnés est nécessaire lorsque cette modalité est utilisée pour traiter l’œsophagite à éosinophiles45. Des régimes d’élimination moins restrictifs ciblant les produits laitiers, les œufs et le blé ont été étudiés puisqu’ils représentent environ 50 % des déclencheurs3,45,46. Le régime d’élimination de 4 aliments retire le lait de vache, le blé et les œufs, le quatrième groupe alimentaire étant soit le soya ou les légumineuses45. Le régime d’élimination de 2 aliments retire le lait de vache et le blé45. Récemment, un essai multicentrique randomisé à étiquetage en clair a comparé un régime d’élimination d’un seul aliment (le lait de vache) à un régime d’élimination de 6 aliments et a conclu à une rémission endoscopique, symptomatologique et cytologique similaire (34 % c. 40 %, IC de 95 % –11 à 23; p < 0,58)47. L’implication précoce de la gastroentérologie et de la diététique pourrait accroître les chances de succès de ce traitement6,35,45.
Les régimes élémentaires jouent un rôle limité et sont réservés aux personnes par ailleurs réfractaires au traitement4,6. Ils se composent de substituts de repas liquides à base d’acides aminés. Les protéines, les graisses et les glucides sont décomposés en acides aminés, en triglycérides à chaîne courte et en maltodextrine à chaîne courte et sont combinés à des vitamines, des minéraux et des électrolytes. Même s’ils sont efficaces, ces régimes ne sont pas des choix populaires auprès des personnes concernées en raison de leur goût, de leur coût élevé et de leurs répercussions négatives sur la qualité de vie2,46.
DilatationDans des circonstances où le diagnostic d’œsophagite à éosinophiles tarde à être posé, la fibrose peut s’installer et modifier le calibre de l’œsophage5. Les personnes qui ont des symptômes de dysphagie pourraient nécessiter une dilatation (figure 3)6. La dilatation endoscopique peut servir à traiter les sténoses et rétrécissements œsophagiens en réduisant le risque d’impaction du bol alimentaire, particulièrement chez les personnes pour qui le traitement pharmacologique ou alimentaire a échoué ou n’a pas encore été utilisé (figure 3). Les personnes qui présentent à répétition des impactions du bol alimentaire et une sténose de l’œsophage (< 17 mm) à l’endoscopie devraient avoir accès à la dilatation pour réduire le risque d’obstruction alimentaire23. La dilatation soulage les symptômes obstructifs, mais ne permet pas de traiter l’inflammation sous-jacente; elle doit donc être alliée à des traitements anti-inflammatoires3,23,35. Lors d’une étude sur des personnes candidates à la dilatation, 65 % des personnes sous traitement pharmacologique ou diététique avaient moins besoin de dilatations à répétition après 2 ans23.
Prise en charge de l’obstruction œsophagienne aiguëOn peut tenter de soulager l’obstruction œsophagienne aiguë par le bol alimentaire au moyen de modalités non effractives. La prise de boissons gazéifiées peut aider à déloger l’impaction alimentaire48. Si cette mesure se révèle inefficace, la personne devrait subir une endoscopie d’urgence. Le glucagon, la butylscopolamine, les anticalciques, les nitrates et les benzodiazépines se sont révélés inefficaces lors de plusieurs études48,49. Une radiographie du thorax avant l’endoscopie a toujours été recommandée pour exclure une perforation de l’œsophage, mais les lignes directrices actuelles ne la recommandent pas en raison du taux élevé de résultats faussement négatifs49.
Même si une modalité non effractive vient à bout de l’obstruction alimentaire, les personnes qui consultent pour cette raison devraient être orientées vers une endoscopie en consultation ambulatoire. Plus de 75 % des cas présenteront une cause sous-jacente à l’obstruction alimentaire, comme l’œsophagite à éosinophiles, la sténose, les troubles de la motilité ou le cancer49. L’absence de suivi est un prédicteur connu de récidive de l’impaction alimentaire49.
Suivi de la personne atteinteLes symptômes et les résultats endoscopiques et histologiques ne sont pas toujours en corrélation les uns avec les autres23,35. Après 8–12 semaines de traitement, il faut réévaluer les personnes en tenant compte des symptômes cliniques et du rétablissement de l’œsophage évalué au moyen d’une autre endoscopie avec biopsies (figure 3)35,50. On cherche actuellement des façons moins effractives d’évaluer la fibrose œsophagienne (p. ex., test de la ficelle Cytosponge et système de planimétrie par impédance EndoFLIP [endoluminal functional lumen imaging probe]), mais leur rôle reste encore à définir35. Le traitement médical devrait continuer jusqu’à la rémission des symptômes et la communication d’information à la personne concernée est cruciale dans ce contexte35,50.
Un suivi clinique et endoscopique de routine doit se poursuivre après la rémission, quoiqu’on n’en ait pas encore établi la fréquence idéale6,23,35. Les lignes directrices et les consensus publiés préconisent désormais un traitement d’entretien pour éviter les rechutes cliniques et histologiques après l’arrêt du traitement4,6,23,35,50. La figure 3 résume la façon d’interpréter les interconnexions entre les symptômes et les signes endoscopiques et histologiques. Il faut adopter la prise de décision partagée entre médecins et malades pour réduire l’incidence sur la qualité de vie causée par la maladie et son traitement (annexe 1, accessible en anglais au www.cmaj.ca/lookup/doi/10.1503/cmaj.230378/tab-related-content)6,8,24.
Un récent effort international de synthèse des paramètres recommandés du point de vue des malades, des médecins et des chercheurs a permis d’établir que les marqueurs les plus importants de l’efficacité du traitement étaient les symptômes rapportés par les malades, les réponses aux questionnaires sur la qualité de vie spécifiques à l’œsophagite à éosinophiles et les résultats histologiques et endoscopiques51. Un questionnaire intégré (I-SEE, pour Index of Severity for Eosinophilic Esophagitis) est en cours de validation afin qu’un seul outil permette aux médecins de stratifier les risques, et de surveiller et suivre les différents paramètres de la maladie au fil du temps52.
留言 (0)