Les plateformes de prise en charge clinique et de gestion des éclosions ont été des outils essentiels pendant la pandémie de COVID-19, mais des systèmes de surveillance étendus sont nécessaires afin de soutenir l’établissement de politiques de santé publique et de mesures de lutte efficaces et équitables, maintenant et à l’avenir.
On devrait mettre en place un système de surveillance dynamique englobant le contrôle des eaux usées, le dépistage dans des échantillons populationnels représentatifs et la génomique afin de surveiller efficacement les tendances des diverses maladies panrespiratoires, de détecter rapidement les résurgences et l’émergence de nouveaux variants et de répondre avec des programmes de santé publique efficaces et adaptés.
Le financement et les ressources nécessaires à l’élaboration, à l’instauration et au maintien de systèmes de surveillance étendus seront considérables, mais les gains essentiels en matière de santé publique comprendront une réduction de la morbidité et de la mortalité, une atténuation des répercussions économiques et une diminution des perturbations sociales au moyen de mesures, de décisions stratégiques et de programmes en matière de santé publique.
Les acteurs multidisciplinaires de la mise en œuvre devraient s’assurer que la participation, la mobilisation communautaire et l’équité des données sont enchâssées dans les systèmes de surveillance.
La surveillance des maladies infectieuses est essentielle aux systèmes de santé publique1. Cependant, les mesures de lutte contre la pandémie de COVID-19 au Canada reposaient sur des plateformes de prise en charge clinique et de gestion des éclosions; c.-à-d., que les agences de santé publique faisaient le suivi du nombre de cas pour tout un éventail de motifs de contrôle (p. ex., symptômes) ou de dépistage (p. ex., exposition, dépistage systématique chez les travailleurs de la santé)2. Bien qu’elles soient importantes pour fournir les soins cliniques et définir des mesures et des tendances à large échelle en matière de santé populationnelle en lien avec la COVID-19, ces plateformes de prise en charge clinique et de gestion des éclosions n’ont pas été conçues pour la surveillance des maladies infectieuses et présentent d’importantes limitations2.
Nous proposons une approche de surveillance par paliers qui englobe le contrôle des eaux usées, le dépistage dans des échantillons populationnels représentatifs (pour dégager, entre autres, des données sur les mécanismes de transmission potentiels; p. ex., les déterminants sociaux de la santé) et la génomique afin de suivre efficacement les tendances des maladies et de détecter rapidement les résurgences et l’émergence de nouveaux variants ou de nouvelles souches. Ces renseignements sont cruciaux afin d’éclairer l’élaboration de programmes de santé publique adaptés et efficaces. Le système proposé pourrait et, ultimement, devrait être déployé au-delà de la COVID-19 afin de soutenir la surveillance des pathogènes panrespiratoires.
Pourquoi le fait de miser strictement sur des plateformes de prise en charge clinique et de gestion des éclosions limite-t-il les interventions en santé publique?Les objectifs des plateformes de dépistage pour la prise en charge clinique et la gestion des éclosions sont de soutenir les soins cliniques (p. ex., diagnostic des patients, détermination du traitement approprié) et la recherche de cas et de contacts par la santé publique (p. ex., dépistage chez les personnes exposées afin de déterminer les besoins en isolement)3. Bien que ces plateformes ne soient pas conçues dans un but de surveillance, un nombre de provinces et de territoires les ont employées comme systèmes de surveillance ponctuels pendant la pandémie de COVID-192. Toutefois, l’utilité des données ainsi obtenues est limitée par des biais en raison de la nature changeante des définitions des cas et des critères de dépistage dans le temps et d’une province ou d’un territoire à l’autre, d’un manque d’uniformité pour tenir compte des différences entre les populations dépistées et d’une détection inadéquate des maladies légères ou asymptomatiques2,4.
À long terme, la dépendance à ces plateformes de prise en charge clinique et de gestion des éclosions engendre des défis pour les interventions en santé publique, en raison d’une sousestimation du nombre de cas, d’une sélection influencée par des comportements de recherche de soins de santé, des retards des indicateurs épidémiologiques et des volumes ingérables du nombre de cas5. Par exemple, les plateformes cliniques réalisent habituellement des tests diagnostiques chez des personnes symptomatiques et sont par conséquent susceptibles de passer à côté de personnes qui ne vont pas chercher à se soumettre à un dépistage, en raison du caractère léger ou asymptomatique de leur maladie, ce qui entraîne une sous-estimation du fardeau de la maladie dans la communauté6. Les inégalités existantes en matière de soins de santé dans les communautés marginalisées ou à faibles revenus — comme un accès réduit aux services de soins de santé et l’utilisation limitée de ces derniers — contribuent à cette sous-estimation7,8. De plus, les données sur les hospitalisations ne saisissent que les cas graves et, comme les patients peuvent se présenter plus tard dans le cours de leur maladie, elles représentent un indicateur retardé de la transmission communautaire9. Mises ensemble, ces limites compromettent l’élaboration de politiques efficaces et équitables.
Quels renseignements les systèmes de surveillance différents offrent-ils pour éclairer la prise de décisions en matière de santé publique?Les systèmes de surveillance offrant des occasions d’aller audelà des plateformes de prise en charge clinique et de gestion des éclosions comprennent la surveillance syndromique, sentinelle et populationnelle, ainsi que des eaux usées.
La surveillance des eaux usées est une méthode innovante relativement peu coûteuse selon laquelle des tests de dépistage systématiques dans des échantillons d’eaux usées fournissent des signes précurseurs de changement des tendances des pathogènes au niveau populationnel10,11. Le séquençage génomique des échantillons d’eaux usées peut être réalisé afin de permettre une détection précoce des nouveaux variants viraux ou des nouvelles souches11. Comme la surveillance des eaux usées ne repose pas sur les interactions avec le système de santé, elle n’est pas influencée par les comportements de recherche de soins de santé. Cependant, bien que ces données puissent être analysées au niveau régional (p. ex., des quartiers), elles ne peuvent pas être reliées à des facteurs sociodémographiques individuels ou au statut vaccinal. Par conséquent, elles ne peuvent pas repérer les personnes infectées dans la population ni fournir des indicateurs de la gravité de la maladie ou des capacités d’échappement immunitaire des nouveaux variants. De plus, malgré le développement rapide des infrastructures de surveillance des eaux usées à l’échelle de projets pilotes de lutte contre la COVID-19, un biais en faveur des communautés urbaines demeure dans la mise en service de ces sites, alors que les provinces et les territoires poursuivent leur transition vers des programmes durables à plus large échelle10.
La surveillance syndromique collecte des renseignements sur les symptômes pertinents (p. ex., toux, fièvre) afin de fournir des signaux précoces de changements dans la dynamique de la maladie au sein de la population, sans besoin d’une confirmation en laboratoire12. Les données syndromiques peuvent être générées par une collecte directe auprès des patients (p. ex., dans les établissements de soins de santé, sur les plateformes de télésanté ainsi que par le biais des applications Web ou mobiles)13,14, les ventes pharmaceutiques de médicaments sans ordonnance (p. ex., antipyrétiques)15 ou par des flux de données automatisés, comme les requêtes des moteurs de recherche (p. ex., Google Trends)16. Toutefois, le large éventail de symptômes et leur chevauchement de nombreuses maladies respiratoires signifient qu’à elles seules, les données syndromiques ont une précision diagnostique limitée pour cibler l’évolution de certaines tendances propres aux pathogènes en vue de planifier les ressources du système de santé17. Un autre enjeu important des données syndromiques concerne la représentativité de la population, particulièrement en ce qui a trait aux données collectées au moyen d’applications Web ou mobiles18. De plus, les flux de données de surveillance syndromique ne sont pas tous associés à des facteurs sociodémographiques au niveau individuel, ce qui, comme la surveillance des eaux usées, limite l’identification des personnes infectées.
La surveillance sentinelle en milieu de soins est généralement utilisée pour surveiller les pathogènes respiratoires par échantillonnage systématique dans les établissements de soins de santé (p. ex., salles de malades, services des urgences, cabinets de médecins) afin de déterminer les pathogènes en circulation et l’évolution relative des maladies, en fonction du temps et selon le lieu5. Les formulaires de signalement de cas sentinelles peuvent fournir des renseignements sociodémographiques détaillés au niveau individuel concernant des tests réalisés sur une multitude de pathogènes (p. ex., SRAS-CoV-2, grippe, virus respiratoire syncytial) et les échantillons peuvent être séquencés afin de déterminer la circulation de nouveaux variants et si leur profil de gravité clinique justifie leur classification à titre de variant préoccupant. Néanmoins, comme pour les plateformes cliniques existantes, la surveillance sentinelle axée sur les soins de santé est influencée par le comportement de recherche de ces soins, peut difficilement être étendue à large échelle à l’extérieur des centres urbains19 et sous-estime possiblement le fardeau de la maladie parmi les personnes asymptomatiques ou atteintes d’une forme légère, ce qui est essentiel à la compréhension de la dynamique de transmission des pathogènes émergents5.
La surveillance populationnelle à l’aide d’échantillonnages aléatoires répétés est utile pour estimer le fardeau de la maladie dans une collectivité et assurer un suivi des tendances temporelles. Dans ces systèmes, les personnes sont échantillonnées indépendamment de leurs comportements de recherche de soins de santé ou de leurs symptômes, ce qui offre un portrait plus juste du fardeau communautaire pour l’ensemble du spectre clinique et social. Tour comme les systèmes sentinelles, la surveillance populationnelle offre des renseignements détaillés au niveau individuel, dont des facteurs de risques mécanistes de transmission, tels que les déterminants sociaux de la santé et les données fondées sur la race20; on peut séquencer les échantillons afin de déterminer la circulation et la gravité de nouveaux variants et on peut ajuster le cadre d’échantillonnage pour de multiples pathogènes. Les modifications intégrées dans les phases de conception et d’analyse, comme le suréchantillonnage de groupes particuliers de la population, peuvent aussi permettre une estimation fiable des résultats pour la santé et mieux éclairer des décisions stratégiques équitables21. Bien qu’un système représentatif de la population offre les renseignements les plus fiables pour la prise de décision, il nécessite un investissement financier substantiel, et la mise en place des réflexions relatives à la conception de l’enquête doit se faire a priori afin d’assurer des taux de réponse adéquats et la représentativité de la population.
Que pouvons-nous apprendre des expériences internationales?Bien que de nombreux pays aient employé un assemblage de flux de données cliniques provenant de plateformes de prise en charge clinique et de gestion des éclosions pour surveiller l’évolution de la COVID-193,5, certains d’entre eux ont mis en œuvre des systèmes de surveillance fiables à l’échelle populationnelle.
Par exemple, en 2020, la Slovaquie a réalisé de multiples séries massives de dépistage par tests antigéniques rapides à l’échelle de la population dans le cadre d’une intervention de santé publique pour mieux comprendre la transmission communautaire, ainsi que cibler et réduire les sources de transmission22. Bien que cette initiative puisse offrir des estimations fiables de la prévalence au sein de la population, l’ampleur des ressources financières et en matière de laboratoire nécessaires n’est pas viable à long terme.
Le Royaume-Uni a utilisé 2 systèmes de surveillance populationnelle fondés sur des échantillonnages aléatoires répétés : le Coronavirus Infection Survey (CIS) et le Real-time Assessment of Community Transmission (REACT)23,24. Le CIS a échantillonné plus de 100 000 personnes de partout au Royaume-Uni de façon bihebdomadaire; l’échantillonnage pouvait varier de façon proportionnelle selon la région, la profession et le groupe ethnique afin d’estimer les tendances dans les sous-populations23. Pendant la vague Omicron, ces systèmes ont relevé un fardeau de COVID-19 plus important dans la population pédiatrique que ce qui avait été rapporté lors des vagues précédentes et un fardeau disproportionné persistant parmi les populations ethniques minoritaires et celles résidant dans des quartiers à faibles revenus25. On a rendu disponibles ces résultats en temps réel afin de soutenir la réponse des pouvoirs publics et de guider la prise de décision individuelle. Ces systèmes sont à la base de la réponse du Royaume-Uni à la COVID-19 et nécessitent des investissements substantiels et durables26.
Dans plusieurs milieux, on a mis en œuvre la surveillance des eaux usées avec succès, dont en Alberta, à Yellowknife et en Ontario, au Canada, ainsi qu’à Dhaka, au Bangladesh, et à Rotterdam, aux Pays-Bas10,11,27. Dans ce dernier cas, le contrôle des eaux usées était réalisé 3 fois par semaine, à 9 endroits. Les résultats du contrôle des eaux usées ont accordé une avance de 6 jours sur la résurgence virale et ont cerné des codes postaux où l’activité virale du SRAS-CoV-2 dans les échantillons d’eaux usées était supérieure à celle obtenue par le dépistage clinique; on a utilisé cette information pour ajouter des lieux de dépistage mobiles et en améliorer l’accès dans des régions sous-représentées10. Bien que le contrôle des eaux usées fournisse des résultats exploitables, il requiert aussi une collaboration étroite entre les ministères de la Santé publique et de l’Environnement pour la mise en œuvre, ainsi que l’analyse et l’interprétation des données10.
À quoi pourrait ressembler un système de surveillance au Canada?Afin de permettre aux systèmes de santé du Canada de se préparer aux menaces des maladies infectieuses — et d’y faire face de façon efficace — un système de surveillance national devrait être fondé sur 4 principes principaux : la détection de maladies représentative de la population fondée sur des méthodes de déclaration normalisées, la disponibilité de données en temps réel pour l’utilisation et l’interprétation, la présence de plateformes agiles adaptables aux dynamiques épidémiques changeantes, ainsi que la mise en œuvre et la conception de plateformes appuyées par la mobilisation et le leadership des communautés touchées de façon disproportionnée, pour faire en sorte que les principes directeurs de la santé publique (c.-à-d., la participation, l’équité et la justice sociale) soient intégrés28,29.
Une stratégie de surveillance dynamique, efficace et représentative à l’aide d’une approche par paliersUn système de surveillance national des pathogènes respiratoires efficace et réactif devrait comprendre trois paliers complémentaires : le contrôle des eaux usées, le dépistage dans des échantillons populationnels représentatifs et la génomique (figure 1).
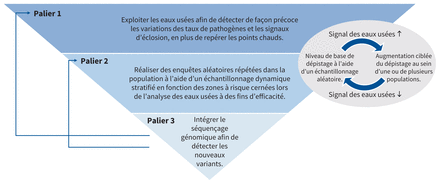
 Figure 1:
Figure 1: Stratégie de surveillance par paliers englobant le contrôle des eaux usées, le dépistage dynamique dans des échantillons populationnels représentatifs et la génomique.
Le premier palier traque les signes de la maladie en analysant des échantillons provenant des installations centralisées d’eaux usées afin de permettre une détection précoce de la résurgence de pathogènes et de la présence d’une épidémie. Ce processus nécessite la collaboration des ministères de la Santé publique et de l’Environnement, avec l’accès à un flux de données coordonnées et à des méthodes d’analyse et de production de rapports normalisées afin de permettre les comparaisons entre les régions11.
Le deuxième palier consiste en une surveillance de populations représentatives à l’aide de trousses de collecte d’échantillons envoyées par la poste, jumelées avec des enquêtes réalisées en ligne, afin de sélectionner aléatoirement des ménages à l’échelle du Canada et parmi des groupes de populations importantes (p. ex., les personnes mal logées, les établissements de soins de longue durée et les populations carcérales) afin de comprendre la composition sociodémographique des populations infectées, particulièrement dans les régions présentant un fort signal provenant du contrôle des eaux usées. Les institutions de santé publique devraient collaborer avec des groupes possédant une expertise en statistiques (p. ex., Statistique Canada) afin de déterminer une stratégie d’échantillonnage appropriée et un nombre d’échantillons de base nécessaire à la production d’estimations fiables des populations qui sont représentatives à l’échelle locale, provinciale, territoriale et fédérale. En mettant à profit les signaux obtenus des eaux usées, le schéma d’échantillonnage devrait être dynamique, et les déclencheurs justifiant une augmentation proportionnée du dépistage dans les régions ou les sous-groupes aux prises avec des niveaux accrus de pathogènes doivent être clairs, afin de permettre un échantillonnage plus efficace et une meilleure connaissance des dynamiques de transmission.
Le troisième palier repose sur le séquençage génomique dans un sous-ensemble représentatif d’échantillons tirés de chaque flux de données. Le séquençage des échantillons d’eaux usées peut offrir un aperçu de l’émergence de variants et de leurs niveaux relatifs de circulation, alors que le séquençage d’échantillons provenant de la population permet une analyse de la gravité d’un variant, de ses propriétés d’échappement immunitaire et de ses avantages de transmission. On pourrait mettre en œuvre cet élément à l’aide d’une collaboration entre les laboratoires de santé publique des niveaux fédéral, provincial et territorial.
Le système par paliers proposé offre une approche intégrée permettant de soutenir des mesures de lutte adaptative aux pathogènes respiratoires à l’aide de l’infrastructure existante, favorisant des estimations neutres de l’incidence et de la prévalence dans le temps et entre les régions géographiques et les sous-populations afin d’éclairer la réponse de la santé publique.
Réflexions de mise en œuvre : participation, mobilisation communautaire et équité des donnéesBien que la mise en œuvre de la surveillance nécessite des efforts coordonnés sur l’ensemble du territoire tout comme des ressources financières substantielles et durables, les retours sur l’investissement seront atteints en diminuant la morbidité et la mortalité, en atténuant les conséquences économiques et en réduisant les perturbations sociales, grâce à la réponse de la santé publique30. Le système proposé pourrait être mis en œuvre à plusieurs niveaux, soit régional, provincial et territorial, ainsi que fédéral. Par le passé, on a recommandé un système de surveillance à plusieurs paliers interreliés par des accords intergouvernementaux et des structures de données et de réglementation harmonisées28. Ceci demeure pertinent et essentiel pour une mise en œuvre réussie de nouveaux systèmes.
On devrait porter une attention particulière à la gouvernance des données, y compris l’harmonisation entre les niveaux local, fédéral, ainsi que provincial et territorial, tout en s’assurant qu’une équité en matière de données en lien avec l’autodétermination et le caractère souverain des peuples autochtones y est enchâssée. Les acteurs de la mise en œuvre devraient provenir des secteurs de la santé publique, de la microbiologie et de l’environnement, sans oublier les dirigeants des collectivités, afin d’assurer la participation et l’acceptation de la population. De plus, une mise en œuvre à tous les niveaux doit comprendre et suivre la mobilisation significative des communautés touchées de façon disproportionnée par les maladies infectieuses surveillées par le système.
Favoriser une prise de décisions fondée sur la surveillanceAfin de favoriser une connaissance en temps opportun et d’orienter des mesures de santé publique équitables, ouvertes et appuyées par des données probantes, les données de surveillances doivent être accessibles en temps réel au milieu de la santé publique et au public en général. La production de rapports en libre accès et en temps réel doit s’arrimer à une communication et une visualisation des données améliorées; cela pourrait comprendre des mises à jour d’analyses et de rapports mis à la disposition de l’ensemble des parties prenantes et du grand public sur une base régulière. Il est essentiel que les dirigeants de la santé publique et des collectivités communiquent des messages clairs sur la manière dont les indicateurs de surveillance sont employés pour orienter les politiques30. L’évaluation des programmes de surveillance doit comprendre non seulement les coûts, mais aussi les avantages pour la santé de la population et le fonctionnement de la société31.
Avantages de la surveillance actuelle et secteurs visés par une expansion futureLa mise en place d’un tel système de surveillance pour le SRASCoV-2 fournit une compréhension de base de la situation épidémiologique changeante de la COVID-19 afin d’orienter une intervention adaptée en santé publique — dont des stratégies de vaccination mises à jour — partout au Canada. À plus long terme, l’infrastructure proposée devrait être déployée pour de multiples pathogènes afin de soutenir une surveillance des pathogènes panrespiratoires. Les méthodes de contrôles des eaux usées peuvent détecter un large éventail de pathogènes respiratoires et non respiratoires, y compris, mais sans s’y limiter, les adénovirus, les entérovirus, les virus de la grippe, les norovirus et les poliovirus32. Des innovations dans les essais de réaction en chaîne par polymérase multiplex pourraient soutenir l’utilisation de plusieurs paires d’amorces dans une seule réaction; des avancées dans les tests de dépistage par lot et les tests groupés pourraient réduire les coûts et améliorer l’efficacité du système33. Par contre, la probabilité de détection et les seuils appropriés pour passer aux paliers suivants concernant différents pathogènes cibles devraient être pris en considération.
L’approche par paliers peut aussi être élargie pour comprendre la surveillance des zoonoses, de la même manière que pour le SRAS-CoV-2 et l’influenza. Une harmonisation entre les agences de santé humaine et animale, au moyen d’une approche comme Une seule santé, pourrait permettre une détection précoce de nouveaux pathogènes ou de variants viraux, de même qu’une transmission potentielle de l’animal à l’humain34. Des paliers élargis pour permettre la détection précoce de nouveaux pathogènes pourraient aussi comprendre une coordination transfrontalière et un dépistage systématique chez les voyageurs ou les résidents arrivant au pays35. Enfin, d’autres flux de données, dont des plateformes de prise en charge clinique et de gestion des éclosions, peuvent être intégrés au système de paliers afin d’orienter les interventions en santé publique.
ConclusionRenforcer la surveillance demeure critique au Canada. Bien que les plateformes de prise en charge clinique et de gestion des éclosions soient essentielles pour les soins cliniques et pour retracer les contacts, des systèmes de surveillance fiables à l’échelle populationnelle sont les plus à même de fournir des données exploitables au sujet de la transmission communautaire du SRAS-CoV-2 et d’autres pathogènes respiratoires émergents et réémergents afin d’orienter des politiques de santé publique proactives et équitables.
RemerciementLes auteurs remercient Ashleigh Tuite pour ses commentaires constructifs sur ce sujet et sur le manuscrit.
FootnotesIntérêts concurrents: Beate Sander déclare recevoir du financement du ministère des Collèges et des Universités comme chercheuse principale d’une intervention de recherche rapide contre la COVID-19. Jusqu’en mars 2022, la Dre Sander occupait le poste de coprésidente du Groupe pour le consensus en matière de modélisation relative à la COVID-19. Sarah Buchan rapporte être cochercheuse pour des travaux de recherche relatifs à l’épidémiologie et l’immunisation subventionnés par les Instituts de recherche en santé du Canada (IRSC) et l’Agence de la santé publique du Canada (ASPC). Jeffrey Kwong déclare recevoir des subventions pour des travaux de recherche en épidémiologie et en immunisation dans le contexte de la COVID-19, financés par les IRSC et l’ASPC. Le Dr Kwong a aussi obtenu une bourse de clinicien-chercheur du Département de médecine familiale et communautaire de l’Université de Toronto. Sharmistha Mishra déclare recevoir des subventions pour des travaux de recherche en épidémiologie et en modélisation dans le contexte de la COVID-19, financés par les IRSC. La Dre Mishra est aussi membre du Groupe pour le consensus en matière de modélisation relative à la COVID-19, elle est soutenue par une chaire de recherche du Canada en science de la modélisation mathématique et programmation de niveau 2. Laura Rosella est financée par une chaire de recherche du Canada en analyse de la santé de la population et la chaire de la famille Stephen en santé communautaire de la fondation Trillium Health Partners. Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Collaborateurs: Tous les auteurs ont contribué à l’élaboration et à la conception du travail. Isha Berry et Beate Sander ont rédigé l’ébauche du manuscrit. Tous les auteurs ont révisé de façon critique son contenu intellectuel important, ont donné leur approbation finale pour la version destinée à être publiée et endossent l’entière responsabilité de tous les aspects du travail.
Soutien financier: Cette étude a été financée en partie par la Chaire de recherche du Canada sur les aspects économiques des maladies infectieuses, détenue par Beate Sander (CRC-950-232429).
This is an Open Access article distributed in accordance with the terms of the Creative Commons Attribution (CC BY-NC-ND 4.0) licence, which permits use, distribution and reproduction in any medium, provided that the original publication is properly cited, the use is noncommercial (i.e., research or educational use), and no modifications or adaptations are made. See: https://creativecommons.org/licenses/by-nc-nd/4.0/
留言 (0)